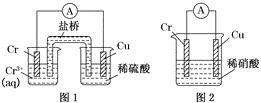
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
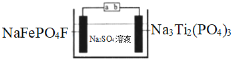
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
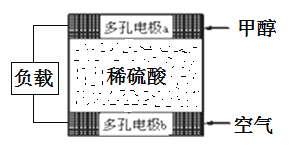
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____
【题目】下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将在杂质除去,并写出相应的方程式(①②写离子方程式,③写化学方程式)。
物质 | 杂质 | 试剂/方法 | 离子/化学方程式 |
①FeCl2 | CuCl2 | ____ | _______ |
②Fe(OH)3 | Al(OH)3 | ____ | _______ |
③Al2O3 | Al(OH)3 | ____ | _______ |