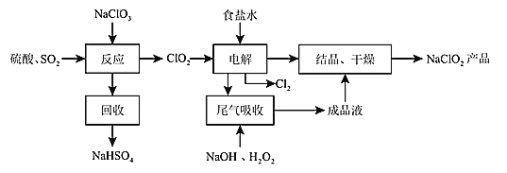
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
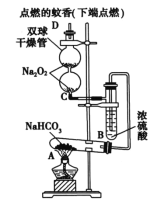
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
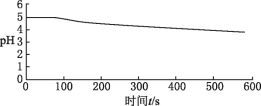
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
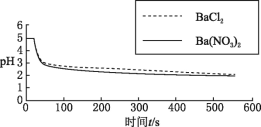
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________