题目内容
【题目】下列A、B、C、D是中学常见混合物分离或提纯的基本装置。请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
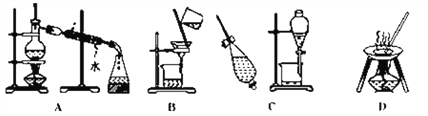
(1)除去Ca(OH)2溶液中悬浮的CaCO3_________________;
(2)从碘水提取碘______________;
(3)用自来水制取蒸馏水_________________;
(4)分离植物油和水_____________;
(5)与海水晒盐原理相符的是_________________。
【答案】 B C A C D
【解析】由装置图可知,A为蒸馏装置、B为过滤装置,C为萃取、分液装置,D为蒸发装置。
(1)CaCO3不溶于水,则选择过滤法分离,故答案为:B;
(2)碘不易溶于水,易溶于有机溶剂,则选择萃取、分液分离,故答案为:C;
(3)水的沸点低,则选择蒸馏法制备蒸馏水,故答案为:A;
(4)植物油和水不互溶,会分层,选择分液法分离,故答案为:C;
(5)海水中水的沸点低,盐的沸点高,与蒸发原理相同,故答案为:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是_____________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________(填“增大”、“减小”、或“不变”)
(4)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧
化碳。该电池的负极反应式为:_______________________________________。
(5)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式____________________________________________________。
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D