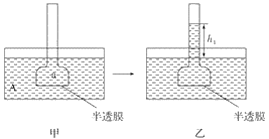
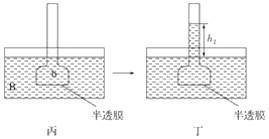
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。

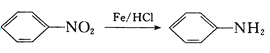
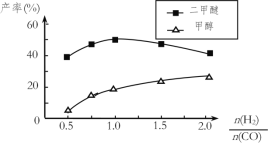
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是________,此时锥形瓶内溶液的pH为_____________。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留四位有效数字)
③排去碱式滴定管中气泡的方法应采用操作__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____
A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
B、锥形瓶水洗后未干燥
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒
E、碱式滴定管尖嘴部分有气泡,滴定后消失
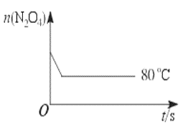
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。