题目内容
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。

【答案】0.0020 mol·L-1·s-1 0.20 80 变浅 D BD 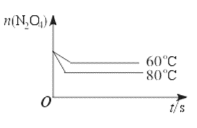
【解析】
(1)先根据二氧化氮物质的量计算反应的四氧化二氮的物质的量,总物质的量减去反应的物质的量即是容器中剩余的四氧化二氮的物质的量,再根据公式v=![]() 计算;(2)根据表格数据分析解答;(3)△H>0,表示反应放热,根据温度对平衡的影响分析判断;(4)K只与温度有关;(5)根据平衡状态的特征分析判断;(6)降低温度,化学反应速率减小,平衡向放热方向移动,据此作图。
计算;(2)根据表格数据分析解答;(3)△H>0,表示反应放热,根据温度对平衡的影响分析判断;(4)K只与温度有关;(5)根据平衡状态的特征分析判断;(6)降低温度,化学反应速率减小,平衡向放热方向移动,据此作图。
(1)根据表中数据可知v(N2O4)=![]() =
=![]() =
=![]() =0.0020 mol·L-1·s-1,故答案为:0.0020 mol·L-1·s-1;
=0.0020 mol·L-1·s-1,故答案为:0.0020 mol·L-1·s-1;
(2)40s时N2O4减少0.40-0.20=0.20mol,由反应可知生成NO2为0.2mol×2=0.4mol,浓度为![]() =0.2mol/L,由表格数据可知80s时达到平衡状态,故答案为:0.2;80;
=0.2mol/L,由表格数据可知80s时达到平衡状态,故答案为:0.2;80;
(3)△H>0,100s后将反应混合物的温度降低,N2O4![]() 2NO2平衡逆向移动,混合气体的颜色变浅,故答案为:变浅;
2NO2平衡逆向移动,混合气体的颜色变浅,故答案为:变浅;
(4)K只与温度有关,该反应为吸热反应,升高温度,K增大,只有D符合,故答案为:D;
(5)A. 反应过程中始终存在2v(N2O4)=v(NO2),无法判断正逆反应速率的关系,不能判断是平衡状态,故A错误;B. 该反应前后气体的物质的量发生变化,即容器中的压强为变量,当容器内压强保持不变,说明反应达到平衡状态,故B正确;C. 反应前后气体的质量不变,容器的体积不变,气体的密度始终不变,因此容器内密度保持不变,不能判断是平衡状态,故C错误;D. NO2的体积分数保持不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;故答案为:BD;
(6)当降低温度,化学反应速率减小,到达平衡所需时间增大,平衡向逆反应方向移动,所以到达新平衡时四氧化二氮的物质的量比第一次平衡时大,60℃曲线为 ,故答案为:
,故答案为: 。
。

【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:

(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。