题目内容
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
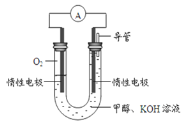
①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。
【答案】Ⅰ < 80% 250℃ CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJ∕mol O2+2H2O+4e﹣=4OH﹣ 2CH3OH+3O2+4OH﹣=2CO32﹣+6H2O
【解析】
(1)①根据“原子经济”的概念分析判断;②根据温度对平衡移动的影响分析判断;③利用三段式计算各自组分物质的量变化量、平衡时的物质的量,依据转化率概念计算CO的转化率;根据浓度计算出平衡常数,再判断温度;
(2)根据盖斯定律计算书写热化学方程式;
(3)碱性甲醇燃料电池中,负极上CH3OH发生氧化反应,正极上氧气发生还原反应,据此书写电极反应式和总反应式。
①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ符合“原子经济”,故答案为:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆反应是吸热反应,正反应放热反应,即△H1<0,故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,CO的物质的量为0.4mol;
CO (g)+2H2 (g)![]() CH3OH (g)
CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=![]() ×100%=80%,此时的平衡常数为:K=
×100%=80%,此时的平衡常数为:K= ≈2.041,所以温度为250℃,故答案为:80%;250℃;
≈2.041,所以温度为250℃,故答案为:80%;250℃;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H1=-1 275.6kJmol-1,②2CO(g)+O2(g)═2CO2(g) △H2=-566.0kJmol-1,③H2O(g)═H2O(l) △H3=-44.0kJmol-1,根据盖斯定律,由![]() [①-②+③×4]得CH3OH(l)+O2(g)═CO(g)+2H2O(l) △H=-442.8kJ/mol,故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(l) △H=-442.8kJ/mol;
[①-②+③×4]得CH3OH(l)+O2(g)═CO(g)+2H2O(l) △H=-442.8kJ/mol,故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(l) △H=-442.8kJ/mol;
(3)①碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②根据①的分析,该电池工作时,总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O。