题目内容
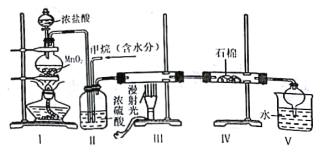
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
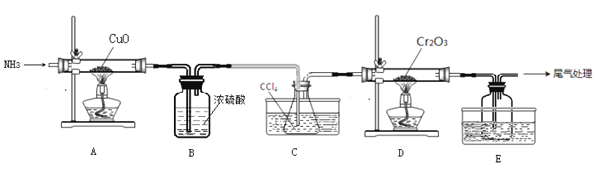
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
【答案】排出空气、吹出CCl4蒸汽、吹出产物及尾气 除去氮气中水蒸气 热水 冷水 Cr2O3+3CCl4![]() 2CrCl3+3COCl2 将连接装置D、E的细导管改成粗导管 除去溶解的氧气,防止将I-氧化 Cr2O72-+ 6I-+14H+= 2Cr3++3I2+7H2O 淀粉溶液 92.5
2CrCl3+3COCl2 将连接装置D、E的细导管改成粗导管 除去溶解的氧气,防止将I-氧化 Cr2O72-+ 6I-+14H+= 2Cr3++3I2+7H2O 淀粉溶液 92.5
【解析】
A装置中氨气和氧化铜在加热条件下生成氮气,B装置干燥氮气,C装置中的![]() 是反应物,氮气将
是反应物,氮气将![]() 吹入反应装置D中,E装置进行尾气吸收。
吹入反应装置D中,E装置进行尾气吸收。
(1)氮气的作用是排出空气、吹出![]() 蒸汽、吹出产物及尾气,故答案为:排出空气、吹出
蒸汽、吹出产物及尾气,故答案为:排出空气、吹出![]() 蒸汽、吹出产物及尾气;
蒸汽、吹出产物及尾气;
(2)由信息①可知装置D中必须保持无水环境,故装置B的作用是干燥氮气;装置C中热水的作用是使![]() 汽化,提供反应所需的反应物;装置E中冷水的作用是冷凝生成的
汽化,提供反应所需的反应物;装置E中冷水的作用是冷凝生成的![]() ,故答案为:除去氮气中水蒸气;热水;冷水;
,故答案为:除去氮气中水蒸气;热水;冷水;
(3)由题意可知,反应物是![]() 和
和![]() ,产物为
,产物为![]() 和
和![]() ,故方程式为:
,故方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)由信息①可知![]() 易升华,题中装置图中D、E之间的导管太细,易发生堵塞,故应将细导管换成粗导管,故答案为:将连接装置D、E的细导管改成粗导管;
易升华,题中装置图中D、E之间的导管太细,易发生堵塞,故应将细导管换成粗导管,故答案为:将连接装置D、E的细导管改成粗导管;
(5)①溶液中有溶解的氧气,氧气可以氧化![]() 氧化,若不除去其中溶解的氧气使生成的
氧化,若不除去其中溶解的氧气使生成的![]() 的量增大,产生偏高的误差,故加热煮沸;
的量增大,产生偏高的误差,故加热煮沸;![]() 和
和![]() 发生氧化还原生成碘单质和铬离子,离子方程式为:
发生氧化还原生成碘单质和铬离子,离子方程式为:![]() ,故答案为:除去溶解的氧气,防止将
,故答案为:除去溶解的氧气,防止将![]() 氧化;
氧化;![]() ;
;
②利用![]() 滴定生成
滴定生成![]() ,
,![]() 遇淀粉显蓝色,所以可以用淀粉作指示剂;设25.00mL溶液中
遇淀粉显蓝色,所以可以用淀粉作指示剂;设25.00mL溶液中![]() ,由
,由![]() 元素守恒及方程式可得关系式:
元素守恒及方程式可得关系式:![]() ,
, ,故
,故![]() ,所以250mL溶液中
,所以250mL溶液中![]() 的物质的量为0.00175mol,根据
的物质的量为0.00175mol,根据![]() 元素守恒可知
元素守恒可知![]() ,所以样品中
,所以样品中![]() ,故样品中无水三氯化铬的质量分数为:
,故样品中无水三氯化铬的质量分数为:![]() ,故答案为:淀粉溶液;92.5。
,故答案为:淀粉溶液;92.5。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
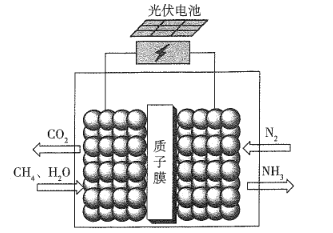
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
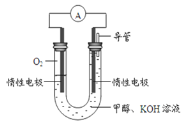
①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。