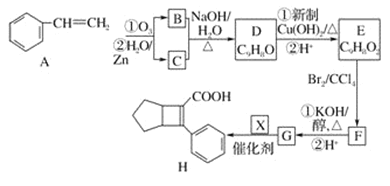
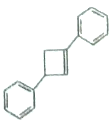
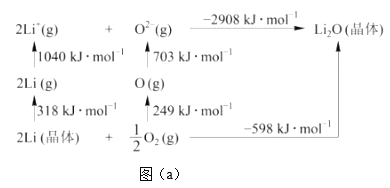
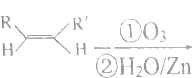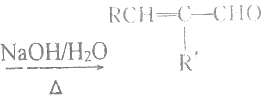【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
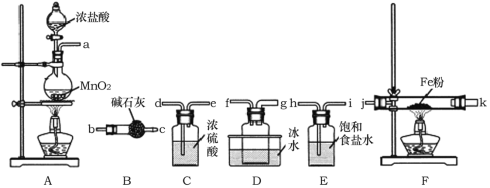
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D