题目内容
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
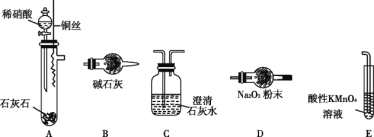
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
【答案】C6H5ONa+CO2+H2O=C6H5OH↓+NaHCO3 C6H5OH+NaOH![]() C6H5ONa+H2O ①、③、②、④ E F 饱和NaHCO3 溶液
C6H5ONa+H2O ①、③、②、④ E F 饱和NaHCO3 溶液
【解析】
I.苯酚具有弱酸性,可以和氢氧化钠反应,生成无色的苯酚钠溶液;苯酚的酸性比碳酸弱,所以将CO2通入C6H5ONa溶液中,生成苯酚;
II.根据实验目的,以及所发生的化学反应,确定实验方案的设计。
I.NaHCO3溶液pH大于等物质的量浓度的CH3COONa溶液,说明乙酸的酸性强于碳酸;苯酚钠和二氧化碳、水反应生成碳酸氢钠,苯酚的溶解性较小变为浊液,说明碳酸的酸性比苯酚强;向含酚酞的NaOH溶液中,各滴加等量的乙醇和苯酚两种溶液,乙醇与氢氧化钠不反应,所以无变化,苯酚具有酸性,和氢氧化钠反应,所以②中红色明显变浅,说明苯酚的酸性强于乙醇。由此证明酸性:乙酸>碳酸>苯酚>乙醇;酸性越强,羟基中的氢原子的活泼性越强,则四种物质中羟基中的氢原子的活泼性由强到弱的顺序是:即①、③、②、④;
故答案为:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3;C6H5OH+NaOH→C6H5ONa+H2O;①、③、②、④;
II.一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验目的是证明酸性:乙酸>碳酸>苯酚.根据强酸制取弱酸的原则,须根据酸性:乙酸>碳酸>苯酚,即乙酸和碳酸钠反应生成二氧化碳(在A装置中),二氧化碳、水和苯酚钠反应生成苯酚和碳酸氢钠(在F装置中);在试管F之前增加了一个盛有饱和NaHCO3溶液的洗气装置,目的是将二氧化碳中的乙酸洗去,防止乙酸与苯酚钠反应,故若A管插入(填字母,下同)D中,则B管插入E中,C管插入F中组装实验仪器。
故答案为:E;F;饱和NaHCO3。

 期末集结号系列答案
期末集结号系列答案