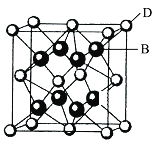
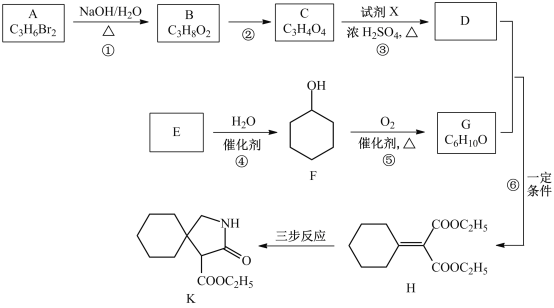
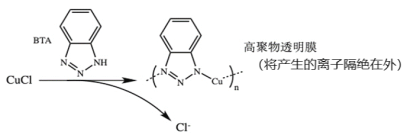
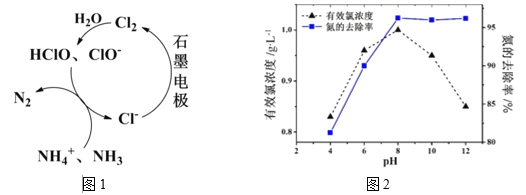
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。

(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH, MnO(OH)中Mn的化合价为:_____,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:________
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:___________。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______。滤液③中可回收的物质为:________(填化学式)。
(5)用硫酸酸化的![]() 浆液可吸收工业废气中的
浆液可吸收工业废气中的![]() 生成
生成![]() ,已知浆液中
,已知浆液中![]() 含量为
含量为![]() ,工业废气中
,工业废气中![]() 含量为
含量为![]() ,
, ![]() 的吸收率可达90%,则处理1000
的吸收率可达90%,则处理1000![]() 工业尾气,可得到
工业尾气,可得到![]() 的质量为____kg(用含字母的代数式表示)。
的质量为____kg(用含字母的代数式表示)。
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。