9.下列有关氯气的叙述中,正确的是( )
| A. | 氯气、氯水、液氯是同一种物质,只是状态不同 | |
| B. | 氯水和液氯都可以使干燥的布条褪色 | |
| C. | 用氯气消毒过的自来水配制硝酸银溶液时,药品不会变质 | |
| D. | 氯水溶液呈浅绿色,且有刺激性气味,说明氯水中有Cl2存在 |
8.下列实验现象的叙述,正确的是( )
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
5.下列说法不正确的是( )

| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
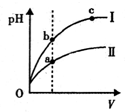
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
4.下列说法或表述中正确的是( )
| A. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| B. | 烷烃 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| C. | 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
3.下列说法不正确的是( )
| A. | 用镊子夹取金属钠固体,切割取用后剩余的钠必须放回原试剂瓶中 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| D. | 在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
2.下列说法不正确的是( )
| A. | 利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响 | |
| B. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| C. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | 酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是酸碱两性物质 |
1.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,该海水中Ca2+的物质的量浓度为5×10-3 mol/L.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如如图1所示.其中阴(阳)离子交换膜只允许
阴(阳)离子通过.
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工
作原理如图2所示:
该电池的电解质是能传导 Li+的固体材料.
则放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为5:1(空气中氧气的体积分数按20%计).

0 173811 173819 173825 173829 173835 173837 173841 173847 173849 173855 173861 173865 173867 173871 173877 173879 173885 173889 173891 173895 173897 173901 173903 173905 173906 173907 173909 173910 173911 173913 173915 173919 173921 173925 173927 173931 173937 173939 173945 173949 173951 173955 173961 173967 173969 173975 173979 173981 173987 173991 173997 174005 203614
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如如图1所示.其中阴(阳)离子交换膜只允许
阴(阳)离子通过.
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工
作原理如图2所示:
该电池的电解质是能传导 Li+的固体材料.
则放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为5:1(空气中氧气的体积分数按20%计).

 如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:

 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.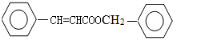 _.
_. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B.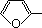 CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3
COOCH2CH2CH3