题目内容
3.下列说法不正确的是( )| A. | 用镊子夹取金属钠固体,切割取用后剩余的钠必须放回原试剂瓶中 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| D. | 在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
分析 A、钠易与空气中氧气和水反应,应保存在煤油中;
B、控制其他量相同,只控制温度不同;
C、Mg与二氧化碳反应;
D、分液时,先从下口放出下层液体,再从上口倒出上层液体.
解答 解:A、做金属钠的性质实验时,剩余的钠放回原试剂瓶,由于钠很活泼,且如果将钠随意丢弃容易引起火灾、爆炸等事故,故A正确;
B、探究温度对反应速率的影响时,控制其他量相同,只控制温度不同,则应将混合物分别在热水、冷水中反应,故B错误;
C、Mg与二氧化碳反应,则不能用泡沫灭火器处理Mg的失火,可用细沙盖灭,故C正确;
D、分液时,避免上下层液体混合,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出,操作合理,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作及实验安全、影响反应速率的因素及物质鉴别等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
7.下列说法正确的是( )
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 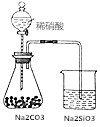 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
14.下列化学式表示的粒子对H2O的电离平衡不产生影响的是( )
| A. |  | B. | 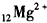 | C. |  | D. | OH- |
11.将20mL 0.3mol/L AgNO3溶液与10mL0.4mol/L CaC12 溶液混合,所得溶液中离子浓度关系正确的是( )
| A. | c(Ca2+)>c(Cl-)>c ( NO3-) | B. | c(Ca2+)>c ( NO3-)>c (Cl-) | ||
| C. | c(NO3-)>c ( Ca2+ )>c ( Cl-) | D. | c ( Cl-)>c(Ca2+)>c(NO3-) |
18.某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,则下列说法正确的是( )
| A. | 若x>z则a>b | B. | x=y>z 则a<b | C. | x=z<y则a=b | D. | x<z=y则a<b |
8.下列实验现象的叙述,正确的是( )
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
15.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3化学式为SiO32-.

(1)基态Si原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3化学式为SiO32-.

13.下列对氧化还原反应的分析中合理的是( )
| A. | 凡是氧化还原反应都有利于生产、生活 | |
| B. | 常温下,钠与氧气的反应属于氧化还原反应,故化合反应都属于氧化还原反应 | |
| C. | 切开金属钠,表面迅速变暗是因为钠与氧气反应,故Na在该反应中作氧化剂 | |
| D. | 反应3S+6NaOH═2Na2S+Na2SO3+3H2O中,S既是氧化剂又是还原剂 |