题目内容
10. 如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:(1)该盐酸中HCl的物质的量浓度为11.8mol/L
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是AD.
A. 溶液的浓度 B. 溶液中氯化氢的物质的量
C. 溶液中氯离子的数目 D. 溶液的密度
(3)现用该浓盐酸配制250mL2mol/L的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤托盘天平;⑥玻璃棒.请回答下列问题:
①经计算,配制250ml2mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为42.4mL,
②配制稀盐酸时,还缺少的仪器有250mL容量瓶、50mL量筒(写出仪器名称及规格);
③对所配制的稀盐酸进行测定,发现其浓度小于2mol/L,引起误差的原因可能是BD.
A. 定容时俯视容量瓶刻度线
B. 转移溶液后,未洗涤烧杯和玻璃棒
C. 溶液注入容量瓶前没有恢复到室温就进行定容
D. 定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)若在标准状况下,将VL氯化氢气体溶于1L水中,所得溶于密度为dg/mL,则此溶液的物质的量浓度为Amol/L.
A. $\frac{1000vd}{36.5v+22400}$ B.$\frac{vd}{36.5v+22400}$ C.$\frac{1000vd}{36.5v+22.4}$ D.$\frac{36.5v}{22.4(v+1)d}$.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
(2)根据该物理量是否有溶液的体积有关判断;
(3)①依据溶液稀释规律计算需要浓盐酸体积;
②依据用浓溶液配制稀溶液的操作步骤选择需要的仪器;
③分析操作对溶质的物质的量n或者溶液的体积V的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作都会使溶液浓度偏低,反之使溶液浓度偏高;
(4)根据n=$\frac{V}{Vm}$计算氯化氢气体的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算该盐酸的物质的量浓度.
解答 解:(1)密度为1.18g/mL,质量分数为36.5%的浓盐酸的物质的量浓度C=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L;
故答案为:11.8mol/L;
(2)A.溶液具有均一性,溶液的浓度与溶液的体积无关,故A选;
B.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故B不选;
C.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故c不选;
D.溶液的密度与溶液的体积无关,故D选;
故选AD;
(3)①设配制250mL2mol/L的稀盐酸需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×11.8mol/L=2mol/L×250mL,解得V=42.4mL;
故答案为:42.4;
②用浓盐酸配制一定物质的量浓度稀盐酸的步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管;
配制250mL溶液,需要选择250mL容量瓶,量取42.4mL浓盐酸,需要使用50mL量筒,所以还缺少的仪器:250mL容量瓶、50mL量筒;
故答案为:250mL容量瓶、50mL量筒;
③A. 定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故A不选;
B. 转移溶液后,未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B 选;
C. 溶液注入容量瓶前没有恢复到室温就进行定容,冷却后,溶液体积偏小,溶液浓度偏高,故C不选;
D. 定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D选;
故选:BD;
(4)HCl的物质的量为n=$\frac{V}{22.4}$mol;HCl的质量为$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为($\frac{36.5V}{22.4}$+1000)g,溶液的体积为$\frac{\frac{36.5V}{22.4}+1000}{1000d}$L;
则溶液的物质的量浓度C=$\frac{\frac{\frac{V}{22.4}}{\frac{36.5V}{22.4}+1000}}{1000d}$=$\frac{1000dV}{36.5V+22400}$mol/L,
故选A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶、量筒规格的选择,注意误差分析的方法.

| A. | 若x>z则a>b | B. | x=y>z 则a<b | C. | x=z<y则a=b | D. | x<z=y则a<b |
| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
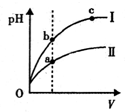
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
(1)基态Si原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3化学式为SiO32-.

| A. | 气态氢化物稳定性:H2Te>H2S | B. | 非金属性:S>Te | ||
| C. | 原子的最外层电子数:S>Te | D. | 原子半径:S>Te |
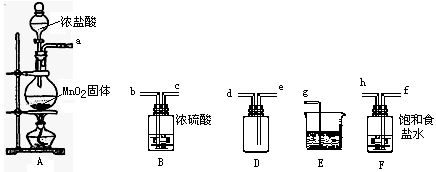
 如图所示装置是实验室常用的气体制取装置.据图回答下列问题:
如图所示装置是实验室常用的气体制取装置.据图回答下列问题: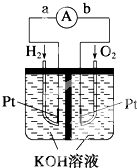 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: