题目内容
4.下列说法或表述中正确的是( )| A. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| B. | 烷烃 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
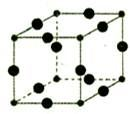
| C. | 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
分析 A.生成等物质的量的CO2和H2O,一定含C、H,可能含O;
B.主链含4个C,2号C上有2个甲基;
C.由图可知分子式,分子中含-CHO;
D.碱性条件下,水解生成羧酸盐和醇.
解答 解:A.生成等物质的量的CO2和H2O,一定含C、H,可能含O,则该有机物的分子式一定CnH2nOm,故A错误;
B.主链含4个C,2号C上有2个甲基,则系统命名为2,2-二甲基-丁烷,故B错误;
C.由图可知分子式为C14H12O2,分子中含-CHO能发生银镜反应,故C正确;
D.碱性条件下,水解生成羧酸盐和醇,则在碱性条件下,CH3CO18OC2H5的水解产物是乙酸盐和C2H518OH,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质及有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.根据下列化学方程式:①2FeCl3+2KI=2FeCl2+I2+2KCl
②6FeCl3+3Br2=2FeBr3+4FeC13.
分析有关离子的还原性由弱到强的顺序是( )
②6FeCl3+3Br2=2FeBr3+4FeC13.
分析有关离子的还原性由弱到强的顺序是( )
| A. | Br-<Fe2+<I- | B. | I-<Fe2+<Br- | C. | Br-<I-<Fe2+ | D. | Fe2+<Br-<I- |
12.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
| A. | 蒸发 | B. | 蒸馏 | C. | 升华 | D. | 萃取 |
19.只用溴水就可以将下列物质鉴别出来的是( )
| A. | NaCl溶液、NaBr溶液、NaI溶液 | B. | 水、CCl4、苯 | ||
| C. | AgNO3溶液、NaOH溶液、KI-淀粉溶液 | D. | Na2SO4、NaCl溶液、KI-淀粉溶液 |
9.下列有关氯气的叙述中,正确的是( )
| A. | 氯气、氯水、液氯是同一种物质,只是状态不同 | |
| B. | 氯水和液氯都可以使干燥的布条褪色 | |
| C. | 用氯气消毒过的自来水配制硝酸银溶液时,药品不会变质 | |
| D. | 氯水溶液呈浅绿色,且有刺激性气味,说明氯水中有Cl2存在 |
13.过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等.
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用.
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是B(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、250mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:2MnO4-+5H2O2+6H+→2Mn2++8H2O+5O2↑;
②该小组一共进行了四次测定实验,实验结果记录如下:
根据所给数据,计算原过氧化氢溶液中H2O2质量分数$\frac{1700C}{8ρ}%$.
(4)下列操作会导致测定结果偏高的是ABC.
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现还原性;
(6)若要验证H2O2不稳定性,操作是取适量过氧化氢溶液于试管中加热,用带火星木条于试管口,木条复燃.
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件.
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用.
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是B(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、250mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:2MnO4-+5H2O2+6H+→2Mn2++8H2O+5O2↑;
②该小组一共进行了四次测定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
(4)下列操作会导致测定结果偏高的是ABC.
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现还原性;
(6)若要验证H2O2不稳定性,操作是取适量过氧化氢溶液于试管中加热,用带火星木条于试管口,木条复燃.
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件.
| 实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
| pH | 11 | 11 | 11 | 10 | |||
| 反应时间 | 3 | 3 | 3 | 3 |
14.4gNaOH溶解在10mL水中,稀释至1L后,取出10mL其物质的量浓度是( )
| A. | 0.1mol/L | B. | 1mol/L | C. | 0.01mol/L | D. | 10mol/L |
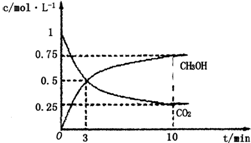 在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: .
.