14.以强制弱是物质世界的普遍规律.已知:四种物质的氧化能力Cl2>Br2>FeCl3>I2,下列氧化还原反应不能发生的是( )
| A. | 2I-+Cl2═I2+2Cl- | B. | 2Br-+Cl2═Br2+2Cl- | ||
| C. | Br2+2I-═2Br-+I2 | D. | 2Fe2++I2═2Fe3++2I- |
10.下列叙述不正确的是( )
| A. | CH4与C4H10互为同系物 | |
| B. | C5H12有三种同分异构体 | |
| C. | 乙烯、乙醇和乙酸都可以使高锰酸钾溶液褪色 | |
| D. | 苯分子中的碳碳键是介于单键和双键之间的独特的键 |
9.糖类、油脂、蛋白质是人体维持生命活动的三大营养物质,下列说法正确的是( )
| A. | 葡萄糖、果糖、蔗糖和淀粉都能发生水解反应 | |
| B. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| C. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的高分子化合物 | |
| D. | 淀粉和纤维素的分子组成相同,它们之间互为同分异构体 |
8.下列说法不正确的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 两种不同的非金属元素形成的化合物中只存在极性共价键 | |
| C. | 共价化合物不可能存在离子键 | |
| D. | 某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键 |
6.已知X、Y元素同周期.且电负性X>Y,下列说法一定错误的是( )
0 173780 173788 173794 173798 173804 173806 173810 173816 173818 173824 173830 173834 173836 173840 173846 173848 173854 173858 173860 173864 173866 173870 173872 173874 173875 173876 173878 173879 173880 173882 173884 173888 173890 173894 173896 173900 173906 173908 173914 173918 173920 173924 173930 173936 173938 173944 173948 173950 173956 173960 173966 173974 203614
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
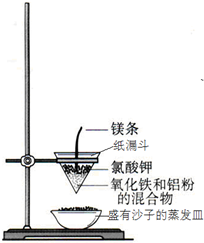 现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.
现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.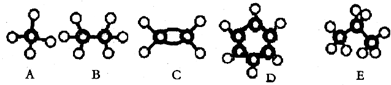
 (填结构简式);
(填结构简式); 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.