15.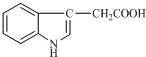 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5mol H2 | |
| D. | 吲哚乙酸苯环上的二氯代物共有四种结构 |
14.钢化玻璃俗称普通玻璃的化身,是普通玻璃经一定物理方法处理后得到的.钢化玻璃一般不会发生自爆现象,但当钢化玻璃中含有硫化镍结核时就有可能发生自爆现象.下列有关说法中错误的是( )
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
13.2015年9月28日,美国宇航局宣布发现了火星上存在液态水的证据.下列关于水的叙述正确的是( )
| A. | 水是一种重要的溶剂,能溶解所有的无机物和大多数有机物 | |
| B. | 水是一种重要的化学试剂,在一定条件下可与许多无机物和有机物发生反应 | |
| C. | 在氧化还原反应中,水只能作氧化剂,不能作还原剂 | |
| D. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,在上述方法中都有化学反应发生 |
12.如何解决好碳排放问题是关系到人类可持续发展的重大课题之一.目前,采用较多的方法是对二氧化碳进行捕集封存和富集再利用.下列与二氧化碳有关的叙述正确的是( )
| A. | CO2是形成酸雨的主要物质 | |
| B. | CO2导致温室效应,是一种大气污染物 | |
| C. | CO2(g)+C(s)$\stackrel{高温}{?}$2CO(g)△H>0,高温有利于该反应自发进行 | |
| D. | 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳 |
10. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大.
9. 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量.该同学选用的药品除样品外,还应有氯化钡溶液;实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平称取该样品5.000g,全部溶于水配制成1 000.0mL溶液.用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在使用前除洗涤外,还应检漏、润洗.
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次.
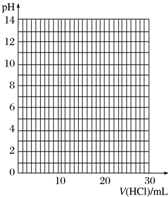
④滴定过程中,锥形瓶中溶液的pH变化如下:
请在坐标图中绘制出上述中和滴定的曲线.
⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是甲基橙或酚酞.
⑥样品中,NaOH的质量百分含量为96%.
(3)以下滴定操作能导致最终滴定结果偏低的是ADF
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗.
0 173731 173739 173745 173749 173755 173757 173761 173767 173769 173775 173781 173785 173787 173791 173797 173799 173805 173809 173811 173815 173817 173821 173823 173825 173826 173827 173829 173830 173831 173833 173835 173839 173841 173845 173847 173851 173857 173859 173865 173869 173871 173875 173881 173887 173889 173895 173899 173901 173907 173911 173917 173925 203614
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.该同学选用的药品除样品外,还应有氯化钡溶液;实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平称取该样品5.000g,全部溶于水配制成1 000.0mL溶液.用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在使用前除洗涤外,还应检漏、润洗.
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次.
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为96%.
(3)以下滴定操作能导致最终滴定结果偏低的是ADF
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗.