题目内容
11.“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是D.
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,可能发生氧化还原反应,下列反应可能发生的是A、B、D、F.
A.NH4NO3→N2+O2+H2O B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O D.NH4NO3→N2+HNO3+H2O
E.NH4NO3→N2+NH3+H2O F.NH4NO3→N2O+H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法.
①H2O2处理法:NaCN+H2O2--N2↑+X+H2O,推测X的化学式为NaHCO3.
②NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e:f的值为B(填选项标号).
A.1 B.$\frac{1}{2}$ C.2 D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验.
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO- 8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为80%.
分析 (1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断;
(3)①结合原子守恒分析X的化学式;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,据此计算.
解答 解:(1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火,故答案为:D;
(2)NH4NO3分解,一种可能是发生复分解反应,还有一种可能是氧化还原反应,根据氧化还原反应中有元素化合价升高就必须有元素化合价降低的原则进行判断:
A、NH4NO3→N2+O2+H2O中N从+5价降为0价,N从-3升为0价,O从-2升为0价,符合氧化还原反应的特征,故正确;
B、NH4NO3→NH3+HNO3满足复分解反应的条件,故正确;
C、NH4NO3→O2+HNO3+H2O中只有化合价升高的,没有化合价降低的,故错误;
D、NH4NO3→N2+HNO3+H2O中N从+5价降为0价,N从-3升为0价,符合氧化还原反应的特征,故正确;
E、NH4NO3→N2+NH3+H2O中虽然N从+5价降为0价,N从-3升为0价,但由于每个N升高的数值小于降低的数值,即消耗的铵根的物质的量要比硝酸根离子多,所以不可能有NH3产生,故错误;
F、NH4NO3→N2O+H2O中N从+5价降为+1价,N从-3升为+1价,符合氧化还原反应的特征,故正确;
故答案为:A、B、D、F;
(3)①NaCN+H2O2--N2↑+X+H2O中,由原子守恒可知X为NaHCO3,故答案为:NaHCO3;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,
故答案为:B;
(4)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为$\frac{1.408g}{44g/mol}$=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为$\frac{0.032mol}{0.04mol}$×100%=80%,
故答案为:80%.
点评 本题考查氧化还原反应的计算及含量测定等,综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案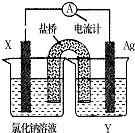 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )| A. | 电极X的材料是Fe | |
| B. | 电解质溶液Y是AgNO3溶液 | |
| C. | 原电池工作时,X电极反应为:Fe-2e-=Fe2+ | |
| D. | 原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
 草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O
草酸亚铁晶体的化学式为FeC2O4•2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑+CO↑+2H2O(1)请你用图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4•2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去).在答题卡上填写表格(可以不用填满,也可以补充).
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 草酸亚铁晶体 | 加热草酸亚铁晶体得到气体产物 |
| D | NaOH溶液 | |
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是FeC2O4•2H2O分解产生的CO将部分FeO还原为粉末状的单质铁,铁粉被空气中的氧气氧化而燃烧.
| X | Y | ||
| Z | W | ||
| T |
| A. | X氢化物的沸点一定比Y氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性一定比W的强 | |
| C. | XZ2、XW4与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 |
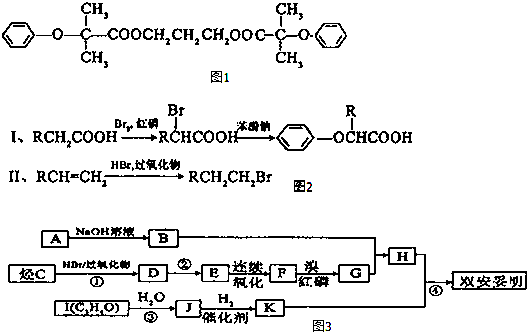
 反应②的条件是氢氧化钠水溶液、加热
反应②的条件是氢氧化钠水溶液、加热
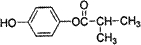
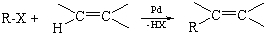
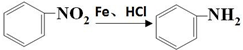

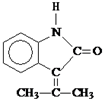 .
.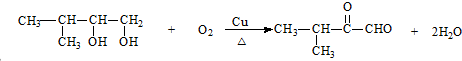 ;F→G:
;F→G: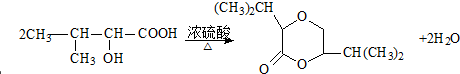 .
.