题目内容
9. 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.该同学选用的药品除样品外,还应有氯化钡溶液;实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平称取该样品5.000g,全部溶于水配制成1 000.0mL溶液.用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在使用前除洗涤外,还应检漏、润洗.
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次.
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为96%.
(3)以下滴定操作能导致最终滴定结果偏低的是ADF
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗.
分析 (1)含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,甲同学运用沉淀法测定样品中NaOH的含量,溶解后加入绿化比溶液完全沉淀硫酸根离子,过滤洗涤称量沉淀质量和样品质量得到质量分数;
(2)①滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定,开始滴定前要调节液面于“0”刻度或“0”刻度以下;
④根据表中数据可以绘制出中和滴定的曲线,注意PH突跃的理解应用:
⑤依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂;
⑥氢氧化钠溶液的浓度为:$\frac{0.1000mol/L×0.024L}{0.02L}$=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,据此计算样品中NaOH的质量百分含量;
(3)A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失,使待测液的体积偏小;
B.滴定结束后,仰视读取酸式滴定管的数据,测得的标准液的体积偏大;
C.锥形瓶内盛装待测液之前有少量蒸馏水,对实验无影响;
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来,则消耗的标准液偏小;
E.酸式滴定管使用前未润洗,标准液被稀释,测得的标准液的体积偏大;
F.碱式滴定管使用前未润洗,使待测液的体积偏小,则消耗的标准液偏小.
解答 解:(1)含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,甲同学运用沉淀法测定样品中NaOH的含量,溶解后加入氯化钡溶液完全沉淀硫酸根离子,过滤洗涤称量沉淀质量和样品质量得到质量分数;
故答案为:氯化钡溶液;样品质量和沉淀的质量;
(2)①滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,滴定管在使用前除洗涤外,还应检漏、润洗;
故答案为:检漏、润洗;
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定,开始滴定前要调节液面于“0”刻度或“0”刻度以下,
故答案为:调节液面于“0”刻度或“0”刻度以下;
④根据表中数据可以绘制出中和滴定的曲线为: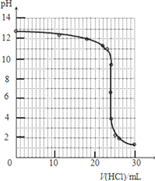 ,
,
故答案为: ;
;
⑤依据图象和图表数据分析可知pH突变是4.0~9.9,盐酸和氢氧化钠恰好反应生成的氯化钠溶液呈中性,甲基橙变色范围为3.1-4.4,酚酞pH变色范围为8.2~10.0,甲基橙和酚酞都可以用作指示剂;由于石蕊变色时不容易判断,一般不选作指示剂;
滴定结束前,溶液为碱性,溶液颜色为红色,滴定结束时有粉红色变成无色,所以滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色),
故答案为:甲基橙或酚酞;
⑥氢氧化钠溶液的浓度为:$\frac{0.1000mol/L×0.024L}{0.02L}$=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,
故样品中,NaOH的质量百分含量为:$\frac{4.800g}{5.000g}$×100%=96%,
故答案为:96%;
(3)A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失,使待测液的体积偏小,则消耗的标准液偏小,所以会导致最终滴定结果偏低;
B.滴定结束后,仰视读取酸式滴定管的数据,测得的标准液的体积偏大,所以会导致最终滴定结果偏高;
C.锥形瓶内盛装待测液之前有少量蒸馏水,对实验无影响;
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来,则消耗的标准液偏小,所以会导致最终滴定结果偏低;
E.酸式滴定管使用前未润洗,标准液被稀释,测得的标准液的体积偏大,所以会导致最终滴定结果偏高;
F.碱式滴定管使用前未润洗,使待测液的体积偏小,则消耗的标准液偏小,所以会导致最终滴定结果偏低;
故选ADF.
点评 本题考查了中和滴定的实验分析判断,步骤和注意问题,滴定计算应用,测定混合物成分的方案设计与分析判断,图象绘制方法,掌握基础是关键,题目难度中等.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案 短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | 甲、乙、丙、丁受热均易分解 | |
| B. | 常温下丁的浓溶液可用 T 单质所制的容器来盛装 | |
| C. | 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体 | |
| D. | R 的氧化物在空气中与其它物质作用可形成光化学烟雾 |
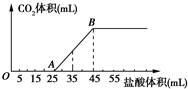
| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO${\;}_{3}^{2-}$+H+═HCO${\;}_{3}^{-}$ | |
| B. | 当加入35 mL盐酸时,产生CO2的体积为224 mL | |
| C. | A点溶液中的溶质为NaCl、NaHCO3 | |
| D. | 混合物中NaOH的质量0.60 g |
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O${\;}_{4}^{-}$)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | CH3COONa溶液:c(Na+)>c(CH3COO-) |
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
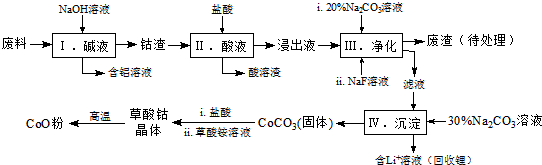
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
| A. | 质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 | |
| B. | 储氢金属吸氢形成金属氢化物,改变条件释放吸收的氢气,是氢气贮存的重要途径 | |
| C. | 牺牲阳极的阴极保护法、外加电源的阳极保护法和改变金属组成或结构的方法都是 防止金属腐蚀的方法 | |
| D. | 乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |