题目内容
6.在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(1)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是c>a=b.
(2)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为a=b=c,反应所需时间的长短关系是a=b>c.
分析 (1)c(H+)相同、体积相同时,生成氢气体积大小与最终氢离子的物质的量成正比;
(2)反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离.
解答 解:(1)当c(H+)相同、体积相同时,醋酸的浓度最大,反应过程中生成的氢离子最多,盐酸和硫酸中氢离子的物质的量相等,所以分别加入足量锌,生成氢气体积为c>a=b,
故答案为:c>a=b;
(2)反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间a=b>c,
故答案为:a=b=c;a=b>c.
点评 本题考查了弱电解质的电离,题目难度中等,明确弱电解质电离特点是解本题关键,注意开始时的反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
17.下列反应的离子方程式中,正确的是( )
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
1.下列有关物质性质和用途的说法,正确的是( )
| A. | NaCl固体与无水乙醇混合无法形成胶体分散系 | |
| B. | 明矾常用作净水剂,是因为它具有消毒杀菌的作用 | |
| C. | 氨常用作制冷剂,是因为其沸点极低,很容易液化 | |
| D. | SiCl4在战争中常用作烟雾弹,是因为它与水反应时生成白色烟雾 |
16.向100mL2.0mol•L-1AlCl3溶液中加入金属钠,完全反应后生成7.8gAl(OH)3沉淀,则加入金属钠的质量可能是( )
| A. | 2.3g | B. | 6.9g | C. | 16.1g | D. | 18.4g |
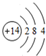 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族. 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸: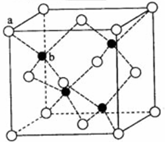 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性. ;B、
;B、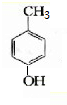 ;
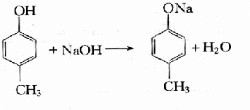
;
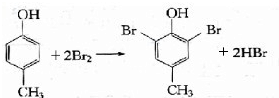 .
.