9.某同学通过系列实验探究Al及其化合物的性质,操作正确且能达到目的是( )
| A. | 将铝片加入浓硫酸中,探究Al的活泼性 | |
| B. | 将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al (OH)3沉淀的生成及溶解 | |
| C. | 将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Al(OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体 |
8.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列关于滤液中的浓度关系正确的是( )
| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
7.能正确表示下列反应的离子方程式是( )
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
6.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 碳元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成3molNa2S2O3,转移8mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出10m3CO2 |
5.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目小于NA | |
| B. | 标准状况下,22.4LCCl4中含有个NACCl4分子 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 足量的H2O2溶液与1molFe2+反应,转移2NA个电子 |
4.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中滴加NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使酚酞变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | NaClO和NaCl混合溶液中:H+、NH4+、SO42-、Br- | |
| C. | 氯化亚铁溶液中:Na+、Ba2+、Br-、NO3- | |
| D. | 0.1 mol•L-1的NaAlO2 溶液:H+、Na+、Cl-、SO42- |
1.下列几种说法中正确的有( )
①用试管加热碳酸氢钠固体时使试管口竖直向上
②稀硝酸可除去试管内壁的银镜
③将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
④蛋白质、乙酸和葡萄糖均属电解质
⑤制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
⑥用硫酸清洗锅炉中的水垢
⑦H2、SO2、CO2三种气体都可用浓硫酸干燥
⑧用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+.
①用试管加热碳酸氢钠固体时使试管口竖直向上
②稀硝酸可除去试管内壁的银镜
③将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
④蛋白质、乙酸和葡萄糖均属电解质
⑤制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
⑥用硫酸清洗锅炉中的水垢
⑦H2、SO2、CO2三种气体都可用浓硫酸干燥
⑧用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+.
| A. | ①③⑤⑦ | B. | ②④⑥⑧ | C. | ②⑤⑦⑧ | D. | ①③④⑥ |
20.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,a的取值范围是5.2≤a≤7.6;过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
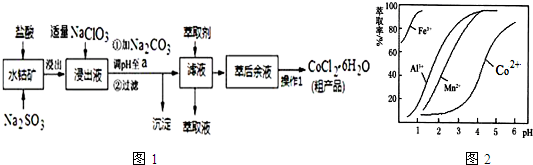
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4g的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤、将沉淀烘干后称其质量为4.6g,则粗产品中CoCl2•6H2O的质量分数是93.0%.(结果保留小数点后一位数字)
0 173662 173670 173676 173680 173686 173688 173692 173698 173700 173706 173712 173716 173718 173722 173728 173730 173736 173740 173742 173746 173748 173752 173754 173756 173757 173758 173760 173761 173762 173764 173766 173770 173772 173776 173778 173782 173788 173790 173796 173800 173802 173806 173812 173818 173820 173826 173830 173832 173838 173842 173848 173856 203614
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,a的取值范围是5.2≤a≤7.6;过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4g的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤、将沉淀烘干后称其质量为4.6g,则粗产品中CoCl2•6H2O的质量分数是93.0%.(结果保留小数点后一位数字)