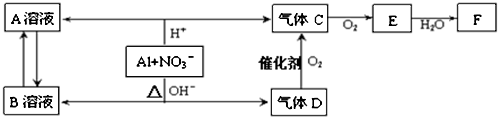
题目内容
2.二氧化硫能使以下溶液褪色:①酸性高锰酸钾溶液,②品红溶液,③滴有酚酞的氢氧化钠溶液,④溴水,其中二氧化硫体现的化学性质相同的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
分析 二氧化硫为酸性氧化物能够与碱反应,具有漂白性能够使品红褪色,具有还原性能够与溴水、酸性高锰酸钾发生氧化还原反应,使高锰酸钾、溴水褪色,据此解答.
解答 解:①二氧化硫使酸性高锰酸钾溶液褪色,体现还原性;
②二氧化硫使品红溶液褪色,体现二氧化硫漂白性;
③二氧化硫使滴有酚酞的氢氧化钠溶液褪色,体现二氧化硫酸性氧化物性质;
④二氧化硫使溴水褪色,体现还原性;
故选:B.
点评 本题考查了元素化合物的性质,熟悉二氧化硫性质是解题关键,注意对基础知识的积累.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
10.下列各组溶液中,各离子一定能大量共存的是( )
| A. | pH=1的溶液:Cu2+、Na+、NO3-、SO42- | |
| B. | 滴加紫色石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、Mg2+、SiO32-、Br- | |
| D. | 滴入KSCN显血红色的溶液中:Na+、Ba2+、Cl-、OH- |
7.能正确表示下列反应的离子方程式是( )
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
11.下列有关实验装置的说法中正确的是( )
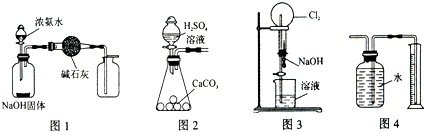

| A. | 用图1装置制取干燥纯净的NH3 | |
| B. | 用图2装置实验室制取大量CO2气体 | |
| C. | 用图3装置可以完成“喷泉”实验 | |
| D. | 用图4装置测量Cu与浓硝酸反应产生气体的体积 |
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: