题目内容
8.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列关于滤液中的浓度关系正确的是( )| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
分析 A.根据Kw=c(H+)×c(OH-)=1.0×10-14计算;
B.根据水的离子积来分析;
C.根据电荷守恒来分析;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),HCO3-的电离程度很小.
解答 解:A.Kw=c(H+)×c(OH-)=1.0×10-14,已知pH<7,即c(H+)>1.0×10-7mol/L,则$\frac{Kw}{c({H}^{+})}$<1.0×10-7mol/L,故A错误;
B.滤液中含NH4Cl,水解显酸性,往滤液中加水稀释,则溶液中c(H+)变小,但由于水的离子积不变,则c(OH-)变大,故B错误;
C.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),由于析出部分NaHCO3晶体,则c(Na+)<c(Cl-),所以c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3-浓度减小,HCO3-的电离程度很小,所以c(CO32-)最小,即c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-),故D正确.
故选D.
点评 本题考查了混合溶液中离子浓度的计算、离子浓度大小比较、电荷守恒的应用,题目难度中等,注意把握电荷守恒的应用方法.

练习册系列答案
相关题目
18.配制450mL、0.1mol/L Na2CO3溶液,需要Na2CO3•10H2O质量为( )
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
19.下列物质中属于氧化物的是( )
| A. | H2O | B. | N2 | C. | O3 | D. | KMnO4 |
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使酚酞变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | NaClO和NaCl混合溶液中:H+、NH4+、SO42-、Br- | |
| C. | 氯化亚铁溶液中:Na+、Ba2+、Br-、NO3- | |
| D. | 0.1 mol•L-1的NaAlO2 溶液:H+、Na+、Cl-、SO42- |
20. 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
17.铁粉在高温下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是( )
| A. | 0.5 mol | B. | 1 mol | C. | 1.5 mol | D. | 2 mol |
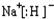 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.