14.用等体积的1.0mol/L的AgNO3溶液,可使相同体积的FeCl3、NaCl、MgCl2 三种溶液中的Cl-完全沉淀,则三种氯化物的物质的量浓度之比为( )
| A. | 3:1:2 | B. | 2:6:3 | C. | 3:6:2 | D. | 1:1:1 |
13.把4.6g钠投入到95.4g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )
| A. | 4.6% | B. | 7.91% | C. | 8.00% | D. | 8.02% |
12.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 甲烷的摩尔质量为16克 | |
| B. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| C. | 常温下,2.7克铝物质的量为0.1 mol | |
| D. | 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA |
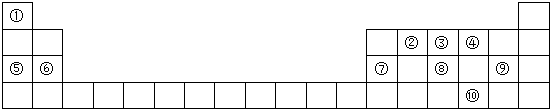
9.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.
0 173519 173527 173533 173537 173543 173545 173549 173555 173557 173563 173569 173573 173575 173579 173585 173587 173593 173597 173599 173603 173605 173609 173611 173613 173614 173615 173617 173618 173619 173621 173623 173627 173629 173633 173635 173639 173645 173647 173653 173657 173659 173663 173669 173675 173677 173683 173687 173689 173695 173699 173705 173713 203614
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是BC.(填序号)
A.氢化物水溶液的酸性 B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性 D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示)S2->Cl-
(4)X元素的某种气态氢化物分子中含有10个电子.该物质在加热条件下能够将CuO还原为Cu,同时生成一种气体,该气体是空气中的成分之一.则反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2.若反应中有6.02×1022个电子发生转移,则有4g的CuO参加反应.


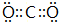 .
.