题目内容
7.氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:(1)为了提高农作物的产量,德国化学家哈伯等科学家成功地开发了将氮气转化为氨气的生产工艺.请用化学方程式表示工业合成氨的反应原理:N2+3H2$?_{催化剂}^{高温高压}$2NH3;
(2)请写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,检验氨气的一种方法是:用湿润的红色石蕊试纸靠近,变蓝色.
分析 (1)工业合成氨的原料为氢气和氮气;
(2)实验室用氯化铵和熟石灰的固体混合物加热来制取氨气,氨气是碱性气体,能使湿润的红色石蕊试纸变蓝.
解答 解:(1)工业合成氨的原料为氢气和氮气,发生反应为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3;
(2)实验室用氯化铵和熟石灰的固体混合物加热来制取氨气,反应为:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,用湿润的红色石蕊试纸靠近,变蓝色证明产生的是氨气,
故答案为:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸靠近,变蓝色.
点评 本题考查氨气的性质,侧重于物质的检验方法的考查,为高考高频考点,难度不大,注意把握氨气的性质,为解答该题的关键.

练习册系列答案
相关题目
17.下列有关实验的与如图所示对应正确的是( )
| A. | 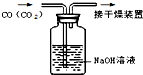 除去CO中的CO2 | |
| B. | 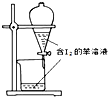 苯萃取碘水中的I2分出水层后的操作 | |
| C. | 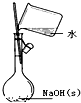 配制0.10mol•L-1 NaOH溶液 | |
| D. | 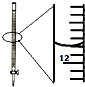 记录滴定终点读数为12.20mL |
18.如图图标中警示腐蚀性物品的是( )
| A. |  | B. |  | C. |  | D. |  |
15.氰气分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似.下列叙述正确的是( )
| A. | 分子中含有2个σ键和4个π键 | |
| B. | 氰气不和氢氧化钠溶液发生反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 分子中的N≡C键的键长大于C-C键的键长 |
2.下列各组物质中互为同分异构体的是( )
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | B. | CH3CH2OH和CH3OCH3 | ||
| C. | O2和O3 | D. | H2O和H2O2 |
12.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 甲烷的摩尔质量为16克 | |
| B. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| C. | 常温下,2.7克铝物质的量为0.1 mol | |
| D. | 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA |
19.实验室中需要0.2mol•L-1的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取胆矾晶体(CuSO4•5H2O)的质量分别是( )
| A. | 950 mL 30.4 g | B. | 950 mL 47.5g | ||
| C. | 1000 mL 50.0 g | D. | 1000 mL 32.0g |
16.化学与材料、生活和环境密切相关.下列说法不正确的是( )
| A. | 塑料、聚酯纤维和光导纤维都属有机高分子材料 | |
| B. | “地沟油”禁止食用,但可用来制造肥皂 | |
| C. | 煤经过气化或液化处理,可获得清洁能源等 | |
| D. | 开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
17.在下列变化中,需要加入合适的氧化剂才能实现的是( )
| A. | KMnO4→O2 | B. | CO2→CO | C. | Br-→Br2 | D. | Fe2O3→Fe |