18.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )
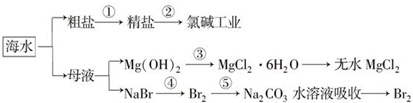

| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业进行制取 | |
| C. | 第③步中结晶出的MgCl2•6H2O可在空气中受热分解制无水MgCl2 | |
| D. | 第④步中溴元素被氧化,第⑤步中既有溴元素被氧化也有溴元素被还原 |
17.下列中既能与水反应生成碱,又能与酸反应生成盐和水的碱性氧化物是( )
| A. | Al2O3 | B. | CuO | C. | CaO | D. | Na2O2 |
16.下列说法中,正确的是( )
| A. | 溴元素只存在于海洋中,故溴被称为“海洋元素” | |
| B. | 硅单质是一种半导体材料,也常用于制造光导纤维 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,瓶口有白烟 | |
| D. | 工业炼铁过程加入石灰石的作用是除脉石(SiO2)造渣 |
15.已知可逆反应a A(g)+b B(?)?c C(g)△H>0(B物质的状态未确定).关于该反应的描述正确的是( )
| A. | 加压若平衡正向移动,则a>c | |
| B. | 加入一定量的B,平衡一定正向移动 | |
| C. | 缩小容器的体积,各物质的浓度一定增大 | |
| D. | 升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定 |
14.用质量均为100g的铜片作电极,电解AgNO3溶液,电解一段时间后两极质量相差28g,此时阳极质量为( )
| A. | 121.6 g | B. | 93.6 g | C. | 89.6 g | D. | 88.2 g |
13.橡皮筋在拉伸和收缩状态时结构如图:在其拉伸过程中有放热现象,反之吸热.25℃、101kPa时,下列化学反应的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )
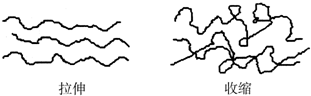

| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O | |
| C. | 2H2+O2═2H2O | |
| D. | CaCO3═CaO+CO2↑ |
12.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |
10.不选用青霉素治疗的是( )
| A. | 肺炎 | B. | 胃酸过多 | C. | 脑膜炎 | D. | 外伤感染 |
9.可逆反应达到平衡时,平衡常数K越大,说明平衡体系中生成物(反应物或生成物)所占的比例越大,它的正 向(正、逆)反应进行的程度越大,K只受温度 影响.
(Ⅰ)已知在448℃时,反应H2(g)+I2(g)═2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)═H2(g)+I2(g)的平衡常数K2为$\frac{1}{49}$;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).当增大压强时,平衡不(填正向、逆向、不)移动
(3)能判断该反应达到化学平衡状态的依据是BC
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
0 173498 173506 173512 173516 173522 173524 173528 173534 173536 173542 173548 173552 173554 173558 173564 173566 173572 173576 173578 173582 173584 173588 173590 173592 173593 173594 173596 173597 173598 173600 173602 173606 173608 173612 173614 173618 173624 173626 173632 173636 173638 173642 173648 173654 173656 173662 173666 173668 173674 173678 173684 173692 203614
(Ⅰ)已知在448℃时,反应H2(g)+I2(g)═2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)═H2(g)+I2(g)的平衡常数K2为$\frac{1}{49}$;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).当增大压强时,平衡不(填正向、逆向、不)移动
(3)能判断该反应达到化学平衡状态的依据是BC
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
 .
.