题目内容
18.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是( )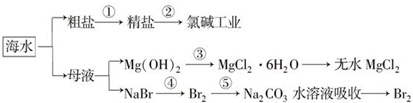
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业进行制取 | |
| C. | 第③步中结晶出的MgCl2•6H2O可在空气中受热分解制无水MgCl2 | |
| D. | 第④步中溴元素被氧化,第⑤步中既有溴元素被氧化也有溴元素被还原 |
分析 根据转化图可知,①为粗盐提纯,利用物质之间的发生及除杂的原则来分析;②为氯碱工业;③为制取氯化镁晶体以及结晶水合物失去结晶水的反应;④为制备溴单质的反应,利用反应中溴元素的化合价来分析.
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,先除硫酸根离子,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
B.工业用电解熔融的氯化钠冶炼钠;
C.氯化镁中的镁离子能水解,酸性环境会抑制水解,MgCl2•6H20要在HCl氛围中加热脱水制得无水MgCl2;
D.根据物质的性质结合元素化合价的变化判断.
解答 解:A.Mg2+、Fe3+用氢氧根离子沉淀,加入过量的氢氧化钠可以将Mg2+、Fe3+沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除Mg2+、Fe3+离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,或BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,选项中的试剂添加顺序中,钡离子最后无法除去,故A错误;
B.氯碱工业为电解饱和食盐水生成氯气、氢气和氢氧化钠的反应,而工业上用电解熔融的氯化钠冶炼钠,故B错误;
C.在过程③中的MgCl2•6H2O灼烧过程中镁离子易水解生成氢氧化镁,在氯化氢气体中脱水可以抑制镁离子水解,故C错误;
D.由④可知NaBr→Br2,NaBr中溴元素的化合价为-1价,单质中溴元素的化合价为0,则在反应中溴元素的化合价升高,由信息可知溴元素被氧化,第⑤步是溴的提纯,既有溴元素被氧化也有溴元素被还原,故D正确;
故选D.
点评 本题考查了海水资源的综合利用,涉及物质的分离和提纯,培养学生分析问题、解决问题的能力,易错选项是A,注意除杂剂加入先后顺序,题目难度中等.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 摩尔是七个基本物理量之一 | |
| B. | 测得1 mol某气体的体积为22.4L,则测定条件一定是标准状况 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 | |
| D. | 凡是只能电离出H+这个阳离子的化合物都是酸 |
表1 几种砷酸盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g•L-1 | 1.6g/L |
| 排放标准 | pH=6~9 | 0.5mg/L |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.29mol/L.
(2)向Al3+、Fe3+的混合溶液中加入Na3AsO4溶液,当两种沉淀共存时,溶液中c(Al3+)和c(Fe3+)的比值为2.8×104.
(3)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4.
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时,酸碱反应,使溶液中AsO43-浓度增大,至Qc>Ksp,Ca3(AsO4)2开始沉淀.
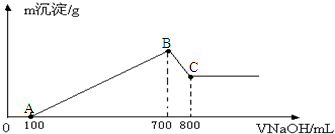
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O | |
| C. | 2H2+O2═2H2O | |
| D. | CaCO3═CaO+CO2↑ |
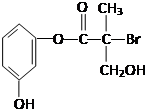
| A. | 该有机物与浓溴水可发生取代反应 | |
| B. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 该有机物能与Na、Na2CO3、NaHCO3溶液发生反应 | |
| D. | 该有机物经催化氧化后与银氨溶液水浴加热,可生成光亮的银镜 |
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.1molN5+离子中所含的电子数为3.4NA | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 用溶有1molFeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有的胶粒数为1.0NA |
| A. | 增大体积 | B. | 升温 | C. | 降温 | D. | 加催化剂 |