8.Na为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
7.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性离子的化学组分及其平均浓度如下表:
根据表中数据计算试样的pH约为4
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)═2H2O(g)K1
2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)?CO(g)+H2(g) K=$\sqrt{\frac{K{\;}_{2}}{{K}_{1}}}$(用含K1、K2的式子表示)
②洗涤含SO2的烟气,以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)═2C(s)+O2(g)
已知该反应的△H>0,简述该设想能否实现的依据:该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)═2H2O(g)K1
2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)?CO(g)+H2(g) K=$\sqrt{\frac{K{\;}_{2}}{{K}_{1}}}$(用含K1、K2的式子表示)
②洗涤含SO2的烟气,以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)═2C(s)+O2(g)
已知该反应的△H>0,简述该设想能否实现的依据:该反应是焓增、熵减的反应.根据△G=△H-T△S,△G>0,不能实现.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
6.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂.
(2)已知,C(s)+CO2(g)?2CO(g);△H=+172.5kJ•mol-1,则反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH-6e-+H2O═CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其他条件不变,降低温度,达到新平衡前v(逆)<v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=0.36.
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)反应C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂.
(2)已知,C(s)+CO2(g)?2CO(g);△H=+172.5kJ•mol-1,则反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH-6e-+H2O═CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=0.36.
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
3.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
0 173377 173385 173391 173395 173401 173403 173407 173413 173415 173421 173427 173431 173433 173437 173443 173445 173451 173455 173457 173461 173463 173467 173469 173471 173472 173473 173475 173476 173477 173479 173481 173485 173487 173491 173493 173497 173503 173505 173511 173515 173517 173521 173527 173533 173535 173541 173545 173547 173553 173557 173563 173571 203614
| A. | C2H5OH(l)+3O2(g)═2CO2 (g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl (aq)═NaCl (aq)+H2O(l)△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ/mol(反应热) | |
| D. | Fe+S═FeS△H=-95.6 kJ/mol(反应热) |

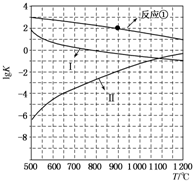 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.