题目内容
8.Na为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
分析 A、求出氯气的物质的量,然后根据氯气与碱的反应为歧化反应;
B、求出甲烷的物质的量,然后根据1mol甲烷中含4mol极性键来分析;
C、溶液体积不明确;
D、重水的摩尔质量为20g/mol.
解答 解:A、标况下22.4L氯气的物质的量为1mol,而氯气与碱的反应为歧化反应,1mol氯气转移1mol电子即Na个,故A正确;
B、16g甲烷的物质的量为1mol,而1mol甲烷中含4mol极性键即4Na个,故B正确;
C、溶液体积不明确,故溶液中的氢离子的个数无法计算,故C错误;
D、重水的摩尔质量为20g/mol,故1.8g重水的物质的量为0.09mol,而1mol重水中含10mol质子,故0.09mol重水中含0.9mol质子即0.9Na个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
20.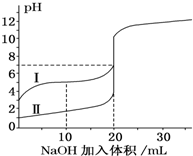 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | V(NaOH)=10.00 mL 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| B. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| C. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
3.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2 (g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl (aq)═NaCl (aq)+H2O(l)△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ/mol(反应热) | |
| D. | Fe+S═FeS△H=-95.6 kJ/mol(反应热) |
13.高炉炼铁是冶炼铁的主要方法,发生的主要反应为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=a kJ•mol-1.
(1)已知:①Fe2O3+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1则a=-28.5kJ•mol-1.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L的恒容密闭容器甲和乙中,分别按照如表所示数据加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是AB(填字母)
a.容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙两容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3的量可以提高CO的转化率
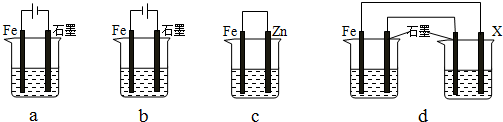
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).
(1)已知:①Fe2O3+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1则a=-28.5kJ•mol-1.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L的恒容密闭容器甲和乙中,分别按照如表所示数据加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是AB(填字母)
a.容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙两容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3的量可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).

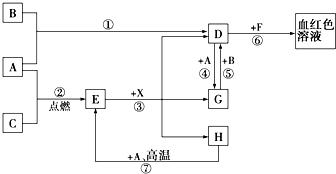 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去). 2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举.火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂.请回答下列问题:
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举.火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂.请回答下列问题: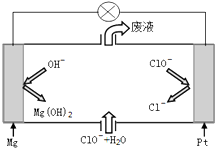 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用. (1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1
(1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1