题目内容
3.下列热化学方程式书写正确的是(△H的绝对值均正确)( )| A. | C2H5OH(l)+3O2(g)═2CO2 (g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl (aq)═NaCl (aq)+H2O(l)△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ/mol(反应热) | |
| D. | Fe+S═FeS△H=-95.6 kJ/mol(反应热) |
分析 根据热化学方程式的书写及其注意事项可知,需注明物质的聚集状态、△H的正负号、数值、单位,燃烧热抓住1mol可燃物燃烧生成稳定氧化物、中和热抓住生成1mol水,且利用燃烧与中和反应放热来解答.
解答 解:A、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故A错;
B、中和反应是放热反应,△H应小于0,故B错;
C、热化学方程式的书写注明了物质的聚集状态、△H的正负号、数值、单位,故C正确;
D、热化学反应方程式要注明物质在反应时的状态,故D错;
故选C.
点评 本题考查燃烧热以及热化学方程式的书写正误判断,重在搞清书写热化学方程式的注意事项.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
15.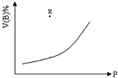 可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )
可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )
 可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )
可逆反应:mA(s)+nB(g)qC(g),在一定温度的密闭容器中进行,B的体积分数(V(B)%)与压强的关系如图所示.下列叙述中正确的是( )| A. | m+n<q | B. | m+n>q | C. | n>q | D. | x点时,v(正)>v(逆) |
16.已知:蜂胶被誉为“紫色黄金”.CPAE是蜂胶的主要活性成分,由咖啡酸与苯乙醇可合成CPAE:

参考上述信息,找出下列说法中不正确的是( )

参考上述信息,找出下列说法中不正确的是( )
| A. | 该反应属于取代反应,CPAE含有三类官能团 | |
| B. | CPAE的分子式为C17H16O4 | |
| C. | 苯乙醇属于醇类,含有苯环的醇类同分异构体有四种 | |
| D. |  与咖啡酸互为同分异构体 与咖啡酸互为同分异构体 |
8.Na为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
15.下列有关热化学方程式的叙述正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
13.CH3COONa溶液存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,下列说法正确的是( )
| A. | 加入少量NaOH固体,c(CH3COO-)减小 | |
| B. | 加入少量FeCl3固体,c(CH3COO-)减小 | |
| C. | 稀释溶液,溶液的pH增大 | |
| D. | 加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
 现有21.6g由CO和CO2组成的混合气体,在标况下其体积为13.44L.回答下列问题:
现有21.6g由CO和CO2组成的混合气体,在标况下其体积为13.44L.回答下列问题:

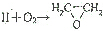 是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2,
是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2, 在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式
在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式 .
. )利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为:
)利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为: ,则反应的流程图为
,则反应的流程图为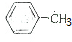 $→_{光照}^{氯气}$
$→_{光照}^{氯气}$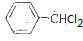 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$ $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$ 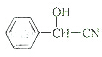 $→_{H_{2}O}^{H+}$
$→_{H_{2}O}^{H+}$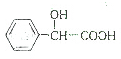 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$