8.下列说法不正确的是( )
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 胶体中分散质微粒能透过滤纸不能透过半透膜 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
6.在溶液中能大量共存的离子组是( )
| A. | Na+、OH一、HCO3- Cu2+ | B. | NH4+、NO3-、OH-、K+ | ||
| C. | H+、K+、CO32-、SO42- | D. | Ba2+、OH一、C1-、Na+ |
4.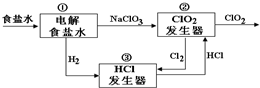 利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )
利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )
 利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )
利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )| A. | 该流程中Cl2、NaCl都可以循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
3.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1molHCl中含有NA个质子 | |
| B. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| C. | 标准状况下,11.2 L乙醇中所含的碳原子数目为NA | |
| D. | 16g的O2与O3混合物中氧原子数为NA |
2.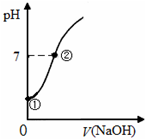 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
1.A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素.由B、G组成的气态化合物甲水溶液呈碱性.
请回答下列问题:
(1)写出甲的电子式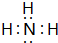 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
a.离子键 b.极性键 c.非极性键
(3)请用电子式表示AE2的形成过程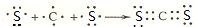 .
.
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
0 173146 173154 173160 173164 173170 173172 173176 173182 173184 173190 173196 173200 173202 173206 173212 173214 173220 173224 173226 173230 173232 173236 173238 173240 173241 173242 173244 173245 173246 173248 173250 173254 173256 173260 173262 173266 173272 173274 173280 173284 173286 173290 173296 173302 173304 173310 173314 173316 173322 173326 173332 173340 203614
| A | B | C | |
| D | E | F |
(1)写出甲的电子式
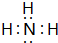 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
a.离子键 b.极性键 c.非极性键
(3)请用电子式表示AE2的形成过程
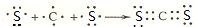 .
.(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.