题目内容
2.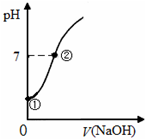 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
分析 向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,根据溶液的酸碱性结合电荷守恒和物料守恒分析解答.
解答 解:A.①点时没有加入氢氧化钠,溶液中存在HClO和水的电离平衡,故A错误;
B.①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,故B错误;
C.②点时溶液存在Cl0-,具有强氧化性,可氧化I-,故C错误;
D.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D正确;
故选D.
点评 本题综合考查氯气的性质,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),为易错点,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列热化学方程式或叙述正确的是( )
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
13.从下列事实所得出的解释或结论正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 已知C(石墨,s)=C(金刚石,s)△H>0 | 金刚石比石墨稳定 |
| B | 2N2O5(g)═4NO2(g)+O2(g)△H>0 该反应在室温下可以自发进行 | 这是一个熵增反应 |
| C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
| D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
10.已知25℃时有关弱电解质的电离平衡常数如下表:
根据上表中数据回答下列问题:
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序CO32->CN->CH3COO-;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为②③① (填序号).
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为CN-+CO2+H2O=HCN+HCO3-
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲﹕c(OH-)乙<10(填“>”、“=”或“<”).
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序CO32->CN->CH3COO-;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为②③① (填序号).
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为CN-+CO2+H2O=HCN+HCO3-
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲﹕c(OH-)乙<10(填“>”、“=”或“<”).
11.部分弱酸的电离平衡常数如表:
(1)请写出HNO2的电离方程式HNO2?H++NO2-
(2)上表的5种酸进行比较,酸性最弱的是:H2S;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是HSO3-.
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:H2C2O4、HCOOH、HC2O4-.
(4)已知HNO2具有强氧化性,弱还原性.将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:2HNO2+H2S=2H2O+2NO↑+S↓.
(5)下列离子方程式书写正确的是DE
A.HNO2+HS-═NO2-+H2S↑ B.2HCOOH+SO32-═2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-═2HCOOH+SO32-D.H2SO3+SO32-═2HSO3-
E.H2C2O4+NO2-═HC2O4-+HNO2
(6)已知HX为一元弱酸.某混合溶液中含有4mol NaX、2mol Na2CO3和1mol NaHCO3.往溶液中通入3mol CO2气体,充分反应后,气体全部被吸收,计算某些物质的量:
Na2CO30mol,NaHCO36mol.
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
(2)上表的5种酸进行比较,酸性最弱的是:H2S;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是HSO3-.
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:H2C2O4、HCOOH、HC2O4-.
(4)已知HNO2具有强氧化性,弱还原性.将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:2HNO2+H2S=2H2O+2NO↑+S↓.
(5)下列离子方程式书写正确的是DE
A.HNO2+HS-═NO2-+H2S↑ B.2HCOOH+SO32-═2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-═2HCOOH+SO32-D.H2SO3+SO32-═2HSO3-
E.H2C2O4+NO2-═HC2O4-+HNO2
(6)已知HX为一元弱酸.某混合溶液中含有4mol NaX、2mol Na2CO3和1mol NaHCO3.往溶液中通入3mol CO2气体,充分反应后,气体全部被吸收,计算某些物质的量:
Na2CO30mol,NaHCO36mol.
12.2015年8月12日晚11时许,天津市塘沽开发区一带发生爆炸事故,现场火光冲天.据多位市民反映,事发时十公里范围内均有震感,抬头可见蘑菇云,截至今日,已近150人遇难.安全问题再次敲响了警钟.下列关于安全问题的说法,不正确的是( )
| A. | 简单辨认有味的化学药品时,将瓶口远离鼻子,用手在瓶口上方扇动,稍闻其味即可 | |
| B. | 处置实验过程产生的剧毒药品废液,稀释后用大量水冲净 | |
| C. | 金属钠着火不能用水灭火,应使用干砂灭火 | |
| D. | 危险化学品包括:爆炸品、易燃物质、自燃自热物质、氧化性气体、加压气体等 |