8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?NH3△H=a kJ•mol-1.试根据表中所列键能数据计算a的数值为-93.
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
6.在25℃、101kPa时,充分燃烧一定量的甲醇,放出热量Q kJ(Q>0),经测定完全吸收生成的二氧化碳需要消耗5mol•L-1的KOH溶液100mL,恰好生成正盐.则此条件下,下列热化学方程式正确的是( )
| A. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-2Q kJ•mol-1 | |
| B. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-4Q kJ•mol-1 | |
| C. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(l)△H=-Q kJ•mol-1 | |
| D. | CH3OH(l)+2O2(g)═CO2(g)+2H2O(g)△H=-4Q kJ•mol-1 |
5.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;\;120℃\;\;\;}}{101kPa}$H2O(g)△H=-242 kJ/mol | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+283.0 kJ•mol-1 |
1.航天燃料从液态变为固态,是一项重要的技术突破.铍是高效率的火箭材料,燃烧时放出巨大的能量,已知1kg金属铍完全燃烧放出的热量为62700kJ.则铍燃烧的热化学方程式正确的是( )
| A. | Be+$\frac{1}{2}$O2═BeO△H=-564.3kJ•mol-1 | |
| B. | Be(s)+$\frac{1}{2}$O2(g)═BeO(s)△H=+564.3kJ•mol-1 | |
| C. | Be(s)+$\frac{1}{2}$O2(g)═BeO(s)△H=-564.3kJ•mol-1 | |
| D. | Be(s)+$\frac{1}{2}$O2(g)═BeO(g)△H=-564.3kJ•mol-1 |
20.在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol HI(a>b),可逆反应2HI(g)?H2(g)+I2(g)达到平衡后,下列说法正确的是( )
| A. | 开始时A容器中的反应速率大于B容器中的反应速率 | |
| B. | 平衡时c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器 |
19.在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )
0 173138 173146 173152 173156 173162 173164 173168 173174 173176 173182 173188 173192 173194 173198 173204 173206 173212 173216 173218 173222 173224 173228 173230 173232 173233 173234 173236 173237 173238 173240 173242 173246 173248 173252 173254 173258 173264 173266 173272 173276 173278 173282 173288 173294 173296 173302 173306 173308 173314 173318 173324 173332 203614
| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |
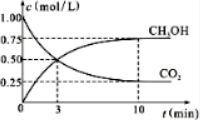
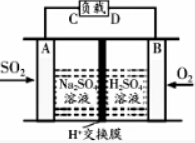
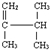 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,