题目内容
3.化学镀镍的溶液中含有Ni2+和H2PO2-在酸性条件下发生如下反应,请配平该反应.1Ni2++1H2PO2-+H2O→1Ni++1H2PO3-+2H+.
分析 反应中镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式、判断还原产物.
解答 解:由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,
故答案为:1;1;H2O;1;1;2H+.
点评 本题考查了氧化还原反应,明确反应中元素的化合价变化及原子守恒为解答的关键,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
9.下列实验操作正确的是( )
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |
14.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
11. “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
①实验1条件下,反应从开始至达到平衡,以v(CO2) 表示的反应速率为0.13mol/(L•min)
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
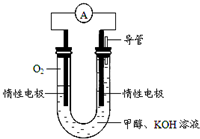
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(保留小数点后二位数,下同).
②实验2条件下平衡常数K=0.17,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
③H2O(g)═H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8KJ/mol.
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应式为:O2+4e-+2H2O=4OH-;该电极上每消耗1.6g氧气,转移的电子数为0.2mol.
②该电池工作时,溶液中的OH-向负(填“正”或“负”)极移动.
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?NH3△H=a kJ•mol-1.试根据表中所列键能数据计算a的数值为-93.
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.