题目内容
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,下列热化学方程式正确的是C
A、$\frac{1}{4}$CH30H+$\frac{3}{8}$02=$\frac{1}{4}$C02+$\frac{1}{2}$H20△H=-113.5kJ•mol-1
B、$\frac{1}{4}$CH30H(l)+$\frac{3}{8}$02(g)=$\frac{1}{4}$C02(g)+$\frac{1}{2}$H20(l)△H=+113.5kJ•mol-1
C、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-908kJ•mol-1
D、2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=+908kJ•mol-1
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2-→TiCl4$→_{800℃,Ar}^{Mg}$Ti
已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的△H=-80kJ•mol-1.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据反应热等于反应物的总键能-生成物的总键能求算;
(3)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式.
解答 解:(1)8g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出热量=113.5KJ×8=908KJ,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-908KJ/mol,
故答案为:C;
(2)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-93kJ•mol-1=a kJ•mol-1,因此a=-93,
故答案为:-93;
(3)已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
依据盖斯定律计算①×2-②+③得到TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)△H=2×(-393.5kJ•mol-1)-(-566kJ•mol-1
)+141kJ•mol-1=-80kJ•mol-1 ,
故答案为:-80kJ•mol-1.
点评 本题考查学生盖斯定律的应用和热化学方程式的书写方面的知识,注意反应热等于反应物的总键能-生成物的总键能、盖斯定律的应用,题目难度中等.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
19.热化学方程式C(s)+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$CO(g)+H2(g);△H=+131.3kJ/mol表示( )
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 | |
| C. | 在298K时,1mol碳(s)和1molH2O(g)反应生成CO(g)和H2(g),吸热131.3kJ | |
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
16.向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ•mol-1.反应过程中测定的部分数据见下表:
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
(1)反应在前50s的平均速率v(PCl5)=0.0016mol/(L•s).
(2)温度为T时,该反应的化学平衡常数=0.025.
(3)上述反应到达平衡状态时,PCl3的体积分数为16.7%.
要提高平衡时PCl3的体积分数,可采取的措施有CD.
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=0.1.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl.
20.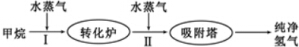 工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
(1)此流程的第II步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数的表达式为$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;反应的平衡常数随温度的变化如下表:
从上表可以推断:此反应是放(填“吸”或“放”)热反应.在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为66.7%.
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3B.2Q1=Q2=Q3C.α1=α2=α3D.α1+α2=1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是②③.
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)
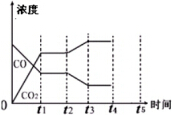
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
 工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:(1)此流程的第II步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数的表达式为$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是②③.
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).

17.燃烧 1g 乙醇(液态)生成CO2气体和液态水放出热量为29.7kJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H5OH+3O2=2CO2+3H2O△H=-29.7 kJ/mol | |
| B. | C2H5OH(l)+3O2 (g)=2CO2 (g)+3H2O(l)△H=+1366.2 kJ/mol | |
| C. | C2H5OH(l)+3O2 (g)=2CO2 (g)+3H2O(g)△H=+29.7 kJ/mol | |
| D. | C2H5OH(l)+3O2 (g)=2CO2 (g)+3H2O(l)△H=-1366.2 kJ/mol |