14.下列物质的使用不涉及化学变化的是( )
| A. | 铝热剂焊接钢轨 | B. | 黏土烧结制陶瓷 | ||
| C. | 氢氟酸刻蚀玻璃 | D. | 甘油作护肤保湿剂 |
13.下列与化学概念有关的说法正确的是( )
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
12.生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
| A. | 明矾是常用的水处理剂,可以淡化海水 | |
| B. | “加碘食盐”、“含氟牙膏”、“富硒营养品”中的碘、氟、硒均以分子形式存在 | |
| C. | 黑火药有硫磺、硝石、木炭三种物质按一定的比例混合而成 | |
| D. | 在食品袋中放入盛有CaCl2.6H2O和铁粉的透气小袋,可防止食物受潮、氧化变质 |
11.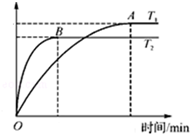 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
 甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇(CH3OH)来源丰富,价格低廉,运输储存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)在25℃、101KPa下,1g甲醇(液态)燃烧生成CO2和液态水放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol.(△H的数值保留小数点后1位)
(2)工业上用CO与H2反应生成甲醇(催化剂为Cu2O/ZnO).一定条件下,在体积为3L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g).甲醇的物质的量随温度的变化如图所示,请回答下列问题:
①该反应正向为放热反应(填“放热”或“吸热”),升高温度,平衡常数K<(填“增大”、“减小”或“不变”).
②该反应的△S<0(填“>”或“<”)在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
③温度为T2时,从反应开始到平衡,H2表示的平均反应速率v(H2)=$\frac{2nB}{3tB}$mol/(L.min).
④在其他条件不变的情况下,将处于C点的平衡体系体积压缩到原来的1/2,重新平衡时,下列有关该体系的说法正确的是BC.
A. H2的浓度减小 B.甲醇的百分含量增大 C.$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$减小 D.$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大
(3)已知反应2CH3OH(g)═CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L,该时间内反应速率v(CH3OH)=0.16mol/L.
7.某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| C. | 保持其他条件不变,升高温度,平衡时c(A)=0.46mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,C(g)?A(g)+B(g)的平衡常数K=1.6 |
6.完全燃烧一定量的无水乙醇(C2H5OH),放出的热量为Q,用6mol/L的NaOH溶液吸收燃烧放出的CO2,消耗50mL时,生成等物质的量的Na2CO3和NaHCO3.则燃烧1mol无水乙醇时放出的热量为( )
| A. | 0.2Q | B. | 0.1Q | C. | 5Q | D. | 10Q |
5.在某一密闭容器中进行下列反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程中某一时刻,SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是( )
0 173111 173119 173125 173129 173135 173137 173141 173147 173149 173155 173161 173165 173167 173171 173177 173179 173185 173189 173191 173195 173197 173201 173203 173205 173206 173207 173209 173210 173211 173213 173215 173219 173221 173225 173227 173231 173237 173239 173245 173249 173251 173255 173261 173267 173269 173275 173279 173281 173287 173291 173297 173305 203614
| A. | SO2为0.4mol/L,O2为0.2mol/L | B. | SO2为0.25mol/L | ||
| C. | SO2和SO3均为0.15molL | D. | SO3为0.4mol/L |
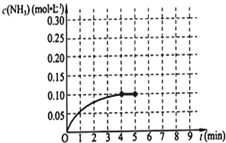 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: