题目内容
9.已知K2Cr2O4溶液中存在下列平衡体系:Cr2O42-+H2O?2CrO42-+2H+.①写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{4}}^{2-})}$.
②向5mL0.1mol/L的K2Cr2O4溶液中滴加10~20滴NaOH溶液产生的现象为溶液黄色加深(或由橙色变黄色或橙色变浅).
③向5mL0.1mol/L的K2Cr2O4溶液中加水,平衡将向正向移动(填“正向”或“逆向”),原因是Qc<K.
分析 (1)化学平衡常数=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$;
(2)5mL0.1mol/L的K2Cr2O4溶液中滴加10~20滴NaOH溶液会消耗氢离子,平衡正向移动;
(3)5mL0.1mol/L的K2Cr2O4溶液中加水,浓度减小,结合Qc和K之间的关系来回答.
解答 解:(1)化学平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{4}}^{2-})}$,故答案为:K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{4}}^{2-})}$;
(2)向5mL0.1mol/L的K2Cr2O4溶液中滴加10~20滴NaOH溶液会消耗氢离子,平衡正向移动,产生的现象为:溶液黄色加深(或由橙色变黄色或橙色变浅),
故答案为:溶液黄色加深(或由橙色变黄色或橙色变浅);
(3)向5mL0.1mol/L的K2Cr2O4溶液中加水,因为Qc=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{4}}^{2-})}$,体积增加导致各组分浓度减小,所以Qc<K,平衡正向移动,故答案为:正向;Qc<K.
点评 本题考查学生化学平衡常数的书写以及应用,注意平衡移动原理的应用是关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列各图所示的实验原理、方法、装置或操作正确的是( )
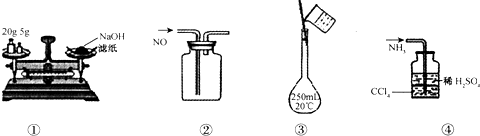

| A. | ①称量氢氧化钠固体 | B. | ②收集NO气体 | ||
| C. | ③配制100 mL 0.10 mol•L-1盐酸 | D. | ④吸收NH3不会造成倒吸 |
17.在以下各种情形下,下列电离方程式的书写正确的是( )
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- | |
| B. | H2CO3的电离:H2CO3═2H++CO32- | |
| C. | 水溶液中的NaHCO3电离:NaHCO3═Na++HCO3- | |
| D. | 水溶液中的Fe(OH)3电离:Fe(OH)3═Fe3++3OH- |
4.已知下列反应的平衡常数:
H2(g)+S(s)?H2S(g),K1;
S(s)+O2(g)?SO2(g),K2.
则反应:H2(g)+SO2(g)?O2(g)+H2S(g)的平衡常数为( )
H2(g)+S(s)?H2S(g),K1;
S(s)+O2(g)?SO2(g),K2.
则反应:H2(g)+SO2(g)?O2(g)+H2S(g)的平衡常数为( )
| A. | K1+K2 | B. | K-K2 | C. | K1×K2 | D. | $\frac{{K}_{1}}{{K}_{2}}$ |
14.下列物质的使用不涉及化学变化的是( )
| A. | 铝热剂焊接钢轨 | B. | 黏土烧结制陶瓷 | ||
| C. | 氢氟酸刻蚀玻璃 | D. | 甘油作护肤保湿剂 |
1.下列现象或事实可以用同一原理解释的是( )
| A. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| B. | 氯化铵和碘都可以用加热的方法进行提纯 | |
| C. | 氯水、SO2均能使品红溶液褪色 | |
| D. | 溴蒸汽和NO2气体都能使湿润的淀粉碘化钾试纸变蓝 |
19.下列叙述正确的是( )
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |