6.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:

(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
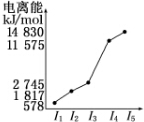
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态,比较稳定.
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).
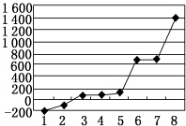
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).

(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

5.下列表示钠原子的式子中能反映能级差别和电子自旋状态的是( )
| A. |  | B. | $\stackrel{23}{11}$Na | ||
| C. | 1s22s22p63s1 | D. | 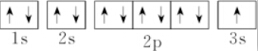 |
2.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L.下列判断中正确的是( )
| A. | A的质量分数增大 | B. | 化学计量数:m+n>3 | ||
| C. | 平衡向右移动 | D. | 物质C的体积分数减小 |
20.某温度时,2NO(g)+O2(g)═2NO2(g)反应到2s后,NO的浓度减少了0.06mol•L-1,则以O2表示该时段的化学反应速率是( )
| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
19.下列说法不正确的是( )
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制芯片 | |
| C. | 可利用二氧化碳制造全降解塑料 | |
| D. | 氯气有毒,不能用于药物的合成 |
17.下列表示对应化学反应的离子方程式正确的是( )
0 173054 173062 173068 173072 173078 173080 173084 173090 173092 173098 173104 173108 173110 173114 173120 173122 173128 173132 173134 173138 173140 173144 173146 173148 173149 173150 173152 173153 173154 173156 173158 173162 173164 173168 173170 173174 173180 173182 173188 173192 173194 173198 173204 173210 173212 173218 173222 173224 173230 173234 173240 173248 203614
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO${\;}_{3}^{+}$+3H2O═3I2+6OH- | |
| B. | 向NH4HSO3溶液中加过量的NaOH溶液并加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O |
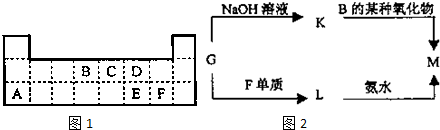
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
 .
.