17.对可逆反应:A(g)+3B(g)?2C(g)△H<0,下列叙述错误的是( )
| A. | 升高温度平衡逆向移,v(正)、v(逆)都增大,但v(逆)增的更大 | |
| B. | 增大压强平衡正移,v(正)、v(逆)都增大,但v(正)增的更大 | |
| C. | 增大A的浓度平衡正移,v(正)会增大,但v(逆)会减小 | |
| D. | 采用催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同 |
16.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图中,Y轴是指( )
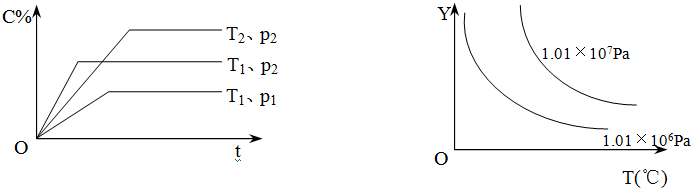
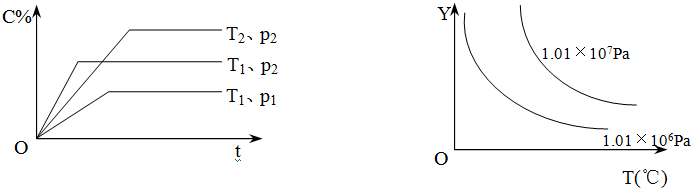
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的百分含量 | ||
| C. | 平衡混合气的密度 | D. | 该反应的正方向的△H>0 |
14.下列有关化学反应速率的说法中,正确的是( )
| A. | 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 |
13. 已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
 已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
已知:Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=+452 kJ/mol | |
| C. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应生成1molNa2CO3(s)时放出509kJ的热量 |
11.已知下列三个数据:7.1×10-4 mol•L-1、6.8×10-4 mol•L-1、6.2×10-10 mol•L-1分别是三种酸的电离平衡常数.若这三种酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是( )
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是( )
| A. | HF的电离平衡常数为7.1×10-4 mol•L-1 | |
| B. | HNO2的电离平衡常数为6.2×10-10 mol•L-1 | |
| C. | 根据①③两个反应即可知三种酸的相对强弱 | |
| D. | HNO2的电离平衡常数比HCN的大,比HF的小 |
10.下列说法正确的是( )
| A. | 对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大 | |
| B. | 对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小 | |
| C. | 活化分子间发生的碰撞为有效碰撞 | |
| D. | 使用催化剂,活化分子百分数增多,化学反应速率增大 |
9.下列各组比较中,前者比后者大的是( )
0 172950 172958 172964 172968 172974 172976 172980 172986 172988 172994 173000 173004 173006 173010 173016 173018 173024 173028 173030 173034 173036 173040 173042 173044 173045 173046 173048 173049 173050 173052 173054 173058 173060 173064 173066 173070 173076 173078 173084 173088 173090 173094 173100 173106 173108 173114 173118 173120 173126 173130 173136 173144 203614
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,同浓度的NaCl溶液和氨水的导电能力 | |
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |
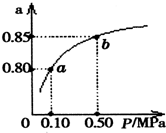 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010mol•L-1,放出热量Q1kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010mol•L-1,放出热量Q1kJ.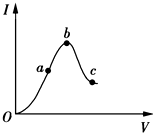 在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.
在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.