12.下列说法正确的是( )
| A. | 根据反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑说明碳的非金属性强于硅的非金属性 | |
| B. | 加热分解CuSO4•5H2O过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒 | |
| C. | 最高化合价为+7的元素一定属于主族元素 | |
| D. | 16gO3含有8NA个电子 |
11.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.X与Y、Z位于相邻的周期.下列说法正确的是( )
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
10.下列有关说法不正确的是( )
| A. | 为防止水污染,可用O3替代Cl2作饮用水消毒剂 | |
| B. | 实验室可用浓硫酸干燥SO2气体 | |
| C. | 16O和18O能形成三种化学性质相同的氧分子 | |
| D. | Al2(SO4)3,可除去碱性废水及酸性废水中的悬浮颗粒 |
9.下列单质或化合物性质的描述正确的是( )
| A. | Na2CO3的溶解性比NaHCO3小 | |
| B. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| C. | FeCl3溶液制作铜质印刷线路板的离子反应为2Fe3++Cu═2Fe2++Cu2+ | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
8.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 二氧化硫在食品加工中可用作食品增白剂 | |
| B. | 航天飞机上的隔热陶瓷瓦属于复合材料 | |
| C. | 用活性炭做净化剂除去冰箱中异味 | |
| D. | 含H2SO4的废水用BaCl2处理后不可直接排放 |
6.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如表实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:i所得溶液中Fe元素的存在形式有Fe2+、Fe3+;
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含A1单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2OH-+2H2O=2AlO2-+3H2↑;
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)该小组同学对ii中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验iii中白色沉淀的化学式是BaSO4;
②结合实验iii和iv分析,实验ii中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)固体成分的初步确定.
①由上述实验可知:i所得溶液中Fe元素的存在形式有Fe2+、Fe3+;
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含A1单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2OH-+2H2O=2AlO2-+3H2↑;
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)该小组同学对ii中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作及现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol•L-1 FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验iii中白色沉淀的化学式是BaSO4;
②结合实验iii和iv分析,实验ii中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
3.A、B、C、D、E、F是周期表中短周期的六种元素,有关性质或结构信息如表:
回答下列问题:
(1)写出C、F的元素符号Na、N;B在周期表中的位置为第三周期ⅢA族.
(2)C与D形成D的最低价化合物的电子式为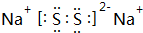 .
.
(3)写出由上述元素形成的可用于漂白的物质的化学式(至少4种)O3、Cl2、Na2O2、NaClO、SO2等.
(4)能证明A与D非金属性强弱的实验事实是(用化学方程式表示)2H2S+O2=2S↓+2H2O.
0 172917 172925 172931 172935 172941 172943 172947 172953 172955 172961 172967 172971 172973 172977 172983 172985 172991 172995 172997 173001 173003 173007 173009 173011 173012 173013 173015 173016 173017 173019 173021 173025 173027 173031 173033 173037 173043 173045 173051 173055 173057 173061 173067 173073 173075 173081 173085 173087 173093 173097 173103 173111 203614
| 元素 | 有关性质或结构信息 |
| A | 地壳中含量最多的元素 |
| B | B阳离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D单质是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小 |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)写出C、F的元素符号Na、N;B在周期表中的位置为第三周期ⅢA族.
(2)C与D形成D的最低价化合物的电子式为
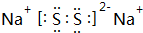 .
.(3)写出由上述元素形成的可用于漂白的物质的化学式(至少4种)O3、Cl2、Na2O2、NaClO、SO2等.
(4)能证明A与D非金属性强弱的实验事实是(用化学方程式表示)2H2S+O2=2S↓+2H2O.
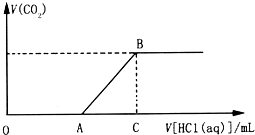 向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点): A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.