题目内容
6.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如表实验.| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)固体成分的初步确定.
①由上述实验可知:i所得溶液中Fe元素的存在形式有Fe2+、Fe3+;
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含A1单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2OH-+2H2O=2AlO2-+3H2↑;
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(3)该小组同学对ii中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作及现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol•L-1 FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验iii中白色沉淀的化学式是BaSO4;
②结合实验iii和iv分析,实验ii中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
分析 (1)Al在高温下与氧化铁反应生成铁和氧化铝,据此写出反应的化学方程式;
(2)①向溶液中加入少量KSCN溶液,溶液呈浅红色,说明溶液中含有Fe3+;溶液变为深红色,说明溶液加入过量双氧水后溶液中铁离子浓度增大,则原溶液中含有Fe2+;
②利用金属铝能够与氢氧化钠溶液反应为铁不反应检验,Al与氢氧化钠溶液反应生成偏铝酸钠和氢气;
③双氧水在催化剂存在条件下能够分解生成水和氧气;
(3)实验ⅱ中溶液红色褪去的原因必然是Fe3+或SCN-被消耗所致,实验ⅲ首先验证实验ⅱ剩余的溶液中存在铁离子,然后证明溶液中存在硫酸根离子,从而证明SCN-被氧化;实验ⅳ证明氧化SCN-的是双氧水,而不是氧气,据此进行解答①②.
解答 解:(1)Al与氧化铁在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)①向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,说明溶液中含有Fe3+,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,说明溶液加入双氧水后溶液中铁离子浓度增大,则原溶液中含有Fe2+,
故答案为:Fe2+、Fe3+;
②金属铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,改写成离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,而铁不与氢氧化钠溶液反应,据此可以检验是否含有Al,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
③双氧水在铁离子作催化剂条件下分解生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
(3)实验ⅱ中溶液红色褪去的原因必然是Fe3+或SCN-被消耗所致,实验ⅲ首先验证实验ⅱ剩余的溶液中存在铁离子,然后证明溶液中存在硫酸根离子,从而证明SCN-被氧化;实验ⅳ证明氧化SCN-的是双氧水,而不是氧气,
①加入氯化钡溶液后生成不溶于盐酸的白色沉淀为BaSO4,故答案为:BaSO4;
②溶液中存在平衡:Fe3++3SCN-?Fe(SCN)3,加入双氧水后SCN-被氧化,SCN-的浓度减小,平衡向着逆向移动,所以溶液红色褪去,
故答案为:溶液中SCN-离子被H2O2氧化,溶液红色褪去.
点评 本题考查了探究探究物质组成及性质实验方案的设计,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握常见物质的性质及性质实验方案设计与评价原则.

 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.(1)一定温度下,向容积恒为2L的密闭容器中通入3mol CO2,3mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.清回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L•min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=v逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2mol C-H键同时消耗1mol H2
D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度.(写两点)
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
在250-400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,催化剂的催化效率降低.
②250℃与400℃时乙酸的生成速率相近,清分析判断实际生产选择的最佳温度是250℃.
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向Na[Al(OH)4]溶液中通入HCl气体至过量 |
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |

回答下列问题:
(1)操作A是蒸发结晶(填实验基本操作名称).要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是b.
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是c(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)操作C是热空气吹出;上图中虚线框内流程的主要作用是富集Br2.
(4)图中虚线框内流程也可用
 替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2(5)已知苦卤的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
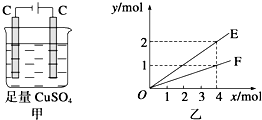
| A. | F表示反应生成Cu的物质的量 | B. | E表示反应生成O2的物质的量 | ||
| C. | E表示反应实际消耗H2O的物质的量 | D. | F表示反应生成H2SO4的物质的量 |
| A. | 空气是混合物--空气由不同种分子构成 | |
| B. | 热胀冷缩--分子的间隔随温度的改变而改变 | |
| C. | 电解水生成氢气和氧气--说明水中含有氢分子和氧分子 | |
| D. | 有同学在教室吃榴莲糖,整个教室都可以闻到榴莲味--分子在不断地运动 |