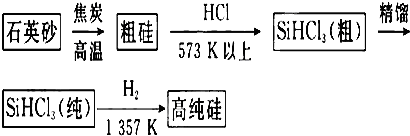
5.实验室制备溴代烃的反应如下:NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据如表;
请回答下列问题:
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是b.
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a. 水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发 d.减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动(或反应②向右移动);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据如表;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是b.
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a. 水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发 d.减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动(或反应②向右移动);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.
2.实验室可利用甲醇、空气和铜制备甲醛.甲醇和甲醛的沸点和水溶性见如表:

如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
(1)若按(乙)装置进行实验,则B管中应装CuO,反应的化学方程式为CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu.
(2)若按(甲)装置进行实验,则通入A管的X是空气(或氧气),B中反应的化学方程式为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
(3)C中应装的试剂是H2O.
(4)在仪器组装完成后,加试剂前都必须要进行的操作是检查装置的气密性;添加药品后,如何检验(乙)装置的气密性?导管口伸入水中,手握试管A,试管C水中有气泡生成,松手后,导气管口内形成液柱,表明装置气密性良好.
(5)两种装置中都需加热的仪器是A、B(填“A”,“B”或“C”),加热的方式分别为A水浴加热,B酒精灯加热.实验完成时,都应先停止对B(填“A”,“B”或“C”)的加热,再撤出C中导管.实验完成时,先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是防止倒吸,其工作原理为:气球内空气进入反应装置,装置内气体压强增大.
(6)你认为哪套装置好?并请说明理由甲,制得的甲醛溶液浓度大.
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 混溶 |
| 甲醛 | -21 | 混溶 |

如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
(1)若按(乙)装置进行实验,则B管中应装CuO,反应的化学方程式为CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu.
(2)若按(甲)装置进行实验,则通入A管的X是空气(或氧气),B中反应的化学方程式为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
(3)C中应装的试剂是H2O.
(4)在仪器组装完成后,加试剂前都必须要进行的操作是检查装置的气密性;添加药品后,如何检验(乙)装置的气密性?导管口伸入水中,手握试管A,试管C水中有气泡生成,松手后,导气管口内形成液柱,表明装置气密性良好.
(5)两种装置中都需加热的仪器是A、B(填“A”,“B”或“C”),加热的方式分别为A水浴加热,B酒精灯加热.实验完成时,都应先停止对B(填“A”,“B”或“C”)的加热,再撤出C中导管.实验完成时,先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是防止倒吸,其工作原理为:气球内空气进入反应装置,装置内气体压强增大.
(6)你认为哪套装置好?并请说明理由甲,制得的甲醛溶液浓度大.
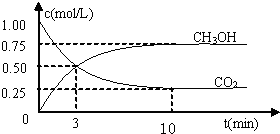
20. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
(1)①由表中数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数减小.
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
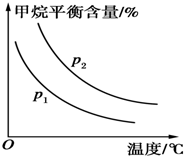
(2)原料气H2可通过反应CH4(g)+H2O(g)?CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1<p2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2(g)+H2 (g)获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5L的容器中进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)?CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1<p2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2(g)+H2 (g)获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5L的容器中进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
19.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;T1温度下的部分实验数据为:
下列说法不正确的是( )
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
18.相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始、达到平衡时的有关数据如表所示:
下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应达平衡时XY3的平衡浓度相同 | |
| B. | 容器①、②中达到平衡时各物质的百分含量相同 | |
| C. | 达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1 | |
| D. | 若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
17.化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题:
I、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)如图1中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
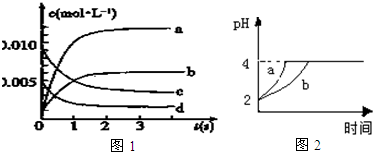
(3)能说明该反应已达到平衡状态的是BE.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2 D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),K值不变(填“增大”、“减小”或“不变”)
II、一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是bc.
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
III、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示,则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1<m2(选填“<”、“=”、“>”).
0 172875 172883 172889 172893 172899 172901 172905 172911 172913 172919 172925 172929 172931 172935 172941 172943 172949 172953 172955 172959 172961 172965 172967 172969 172970 172971 172973 172974 172975 172977 172979 172983 172985 172989 172991 172995 173001 173003 173009 173013 173015 173019 173025 173031 173033 173039 173043 173045 173051 173055 173061 173069 203614
I、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图1中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.

(3)能说明该反应已达到平衡状态的是BE.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2 D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),K值不变(填“增大”、“减小”或“不变”)
II、一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是bc.
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
III、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示,则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1<m2(选填“<”、“=”、“>”).
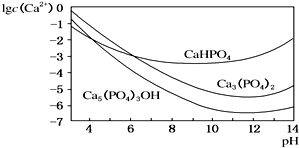 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种: