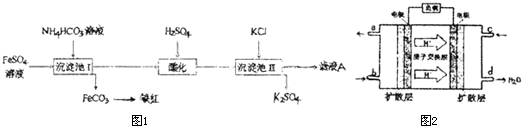
题目内容
4.在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:(1)x值等于2;
(2)A的转化率为60%;平衡时C的体积分数为20%;
(3)该反应的化学平衡常数为0.5.若温度升高,K变大,则该反应为吸热反应.(填“吸热”或“放热”);
(4)如果增大反应体系的压强,则平衡体系中C的质量分数不变;(填“增大”或“减小”或“不变”)
(5)若温度不变,平衡时向该容器中再充入1molA和1molD两种气体,则平衡向正反应方向移动.(填“正”或“逆”)
分析 在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,生成C为0.4mol/L×2=0.8mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(1)物质的量之比等于化学计量数之比,则x=2;
(2)A的转化率=$\frac{转化的A的物质的量}{A的起始物质的量}$×100%;C的体积分数=$\frac{C的物质的量}{混合气体总物质的量}$;
(3)反应前后气体物质的量不变,用物质的量代替浓度代入K=$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$计算平衡常数;
若温度升高,K变大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动;
(4)反应前后气体的体积不变,增大反应体系的压强,平衡不移动;
(5)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,生成C为0.4mol/L×2=0.8mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(1)物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:2,解得x=2,
故答案为:2;
(2)A的转化率=$\frac{1.2mol}{2mol}$×100%=60%;C的体积分数=$\frac{0.8mol}{4mol}$=20%,
故答案为:60%;20%;
(3)反应前后气体物质的量不变,可以用物质的量代替浓度计算平衡常数,故K=$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$=$\frac{0.{8}^{2}×0.{8}^{2}}{0.{8}^{3}×1.6}$=0.5;
若温度升高,K变大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动,正反应为吸热反应,
故答案为:0.5;吸热;
(4)反应前后气体的体积不变,增大反应体系的压强,平衡不移动,则平衡体系中C的质量分数不变,
故答案为:不变;
(5)此时浓度商Qc=$\frac{0.{8}^{2}×1.{8}^{2}}{1.{8}^{3}×1.6}$=0.22<K=0.5,反应向正反应进行,
故答案为:正.
点评 本题考查化学平衡计算与影响因素、平衡常数计算及应用等,注意理解掌握根据平衡常数与浓度商判断反应进行方向.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 乙烷的结构式:C2H6 | |
| B. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| C. | 乙炔的电子式: | |
| D. | 乙醇分子的比例模型: |
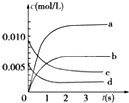 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内温度保持不变.
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
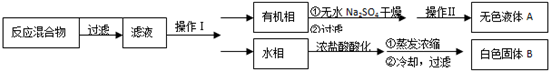
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 与石灰乳反应时,Cl2既被还原,同时又被氧化 | |
| D. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2与铁不能发生化学反应 |