题目内容
1.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
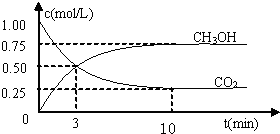
①反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L•min).H2的转化率为75%.
②下列措施中能使n(CH3OH)/n(CO2)增大的是CD.
A、升高温度 B、充入He(g),使体系压强增大 C、将H2O(g)从体系中分离
D、再充入1mol CO2和3mol H2 E、使用催化剂 F、扩大容器体积
(2)①反应进行到3分钟时,同种物质的v正 与v逆的关系:v正>v逆 (填>,=,<)
②上述反应平衡常数的表达式为$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,经计算该温度下此反应平衡常数的数值为$\frac{16}{3}$.
分析 (1)①由方程式可知:△c(H2)=3△c(CH3OH)=2.25mol/L,再根据v=$\frac{△c}{△t}$计算v(H2),转化率=$\frac{浓度变化量}{起始浓度}$×100%;
②使n(CH3OH)/n(CO2)增大,可以改变条件使平衡正向移动,注意不能增大二氧化碳或降低甲醇的量;
(2)①3min后甲醇浓度增大到不变,二氧化碳浓度减小到不变,故3min时反应向正反应进行;
②平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,计算各组分的平衡浓度,代入平衡常数表达式计算.
解答 解:(1)①由方程式可知:△c(H2)=3△c(CH3OH)=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol/(L•min),转化率=$\frac{2.25mol/L}{\frac{3mol}{1L}}$×100%=75%;
故答案为:0.225;75%;
②A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
E.使用催化剂,平衡不移动,n(CH3OH)/n(CO2)不变,故E错误,
F.扩大容器体积,增大减小,平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故F错误,
故答案为:CD;
(2)①3min后甲醇浓度增大到不变,二氧化碳浓度减小到不变,故3min时反应向正反应进行,故v正>v逆,
故答案为:>;
②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,
由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故该温度下平衡常数K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$
故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;$\frac{16}{3}$.
点评 本题考查化学平衡的计算与影响因素、反应速率计算、平衡常数等,难度中等,注意基础知识的掌握.

| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;制取溴苯的化学方程式C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.该反应的催化剂为FeBr3.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:除去HBr和未反应的Br2.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)取反应后烧杯中的溶液2ml加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成,不能(能或不能)证明苯与液溴反生了取代反应,为什么?挥发出来的溴进入烧杯中与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀.
| A. | 铁粉与氯化铁溶液混合:Fe+Fe3+=2Fe2+ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| A. | 次氯酸的化学式:HClO2 | B. | 硫离子的结构示意图: | ||
| C. | 质量数为127的钡原子:127Ba | D. | 氨气(NH3)中氮元素的化合价:+3 |
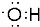 ;
;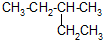 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷;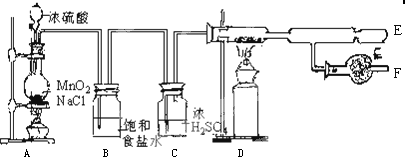
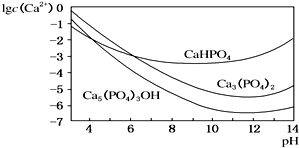 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种: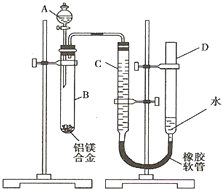 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: