题目内容
19.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;T1温度下的部分实验数据为:| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
分析 A.500s内N2O5的浓度变化量为(5-3.52)mol/L=1.48mol/L,根据v=$\frac{△c}{△t}$计算v(N2O5);
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,则:
2N2O5(g)?4NO2(g)+O2(g)
起始浓度(mol/L):5 0 0
变化浓度(mol/L):2.5 5 1.25
平衡浓度(mol/L):2.5 5 1.25
平衡常数K=$\frac{{c}^{4}(N{O}_{2})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$,转化率=$\frac{浓度变化量}{起始浓度}$×100%;
C.其他条件不变时,若温度T2高,到达平衡时间缩短,正反应为吸热反应,平衡正向移动,1000s时N2O5(g)浓度应小于2.5mol/L;
D.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
解答 解:A.500s内N2O5的浓度变化量为(5-3.52)mol/L=1.48mol/L,则v(N2O5)=$\frac{1.48mol/L}{500s}$=2.96×10-3 mol/(L•s),故A正确;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,则:
2N2O5(g)?4NO2(g)+O2(g)
起始浓度(mol/L):5 0 0
变化浓度(mol/L):2.5 5 1.25
平衡浓度(mol/L):2.5 5 1.25
平衡常数K=$\frac{{c}^{4}(N{O}_{2})×c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$=$\frac{{5}^{4}×1.25}{2.{5}^{2}}$=125,1 000 s时N2O5转化率=$\frac{2.5mol}{5mol}$×100%=50%,故B正确;
C.其他条件不变时,若温度T2高,到达平衡时间缩短,正反应为吸热反应,平衡正向移动,1000s时N2O5(g)浓度应小于2.5mol/L,故不可能为升高温度,应为降低温度,故T1>T2,故C错误;
D.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若K1>K3,则T1>T3,故D正确,
故选:C.
点评 本题考查化学平衡有关计算、化学平衡影响因素、平衡常数等,难度中等,注意理解掌握外界条件对平衡移动的影响.

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案| A. | 是含碳元素的化合物都属于有机物 | |
| B. | 有机物所发生的反应,一般比较复杂,速度缓慢,并且还常伴有副反应发生 | |
| C. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| D. | 所有的有机物都很容易燃烧 |
| A. | N的转化率是20% | B. | x=4 | ||
| C. | 平衡时M的物质的量为2.8 mol | D. | 平衡时气体总压强比原来减小 |
| A. | 62 g | B. | 78mol?L-1 | C. | 78g?mol-1 | D. | 62mol |
| A. | 碘的升华 | B. | 碘化银用于人工降雨 | ||
| C. | 液溴的挥发 | D. | 从海水中提取溴 |
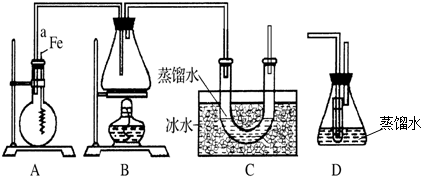
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$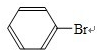 +HBr.
+HBr.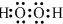 .
.