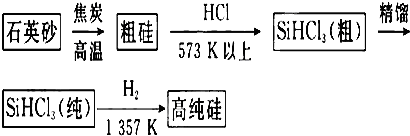
题目内容
18.相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始、达到平衡时的有关数据如表所示:| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应达平衡时XY3的平衡浓度相同 | |
| B. | 容器①、②中达到平衡时各物质的百分含量相同 | |
| C. | 达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1 | |
| D. | 若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
分析 A.容器②中按化学计量数转化到左边可得X20.2mol,Y20.6mol,所以X2总量为1mol,Y2总量为3mol,恒温恒容下,容器①、②中达到平衡为等效平衡,平衡时相同组分的浓度相等;
B.容器①、②中达到平衡为等效平衡;
C.由达平衡时①放出的热为46.3kJ,计算平衡时XY3的物质的量浓度,再根据两平衡是完全等效平衡解答;
D.体积为0.20L,增大压强,增大压强平衡向正反应方向移动,反应物转化率增大.
解答 解:A.容器②中按化学计量数转化到左边可得X20.2mol,Y20.6mol,所以X2总量为1mol,Y2总量为3mol,与容器①中对应物质的物质的量相等,恒温恒容下,容器①、②中达到平衡为等效平衡,平衡时XY3的平衡浓度相同,故A正确;
B.恒温恒容下,容器①、②中达到平衡为等效平衡,平衡时相同组分的百分含量相同,故B正确;
C.①容器中放出46.3kJ热量,则生成XY3的物质的量为:$\frac{46.3kJ}{92.6kJ}$×2mol=1mol,此时XY3的物质的量浓度为$\frac{1mol}{0.25mol}$=4 mol/L,恒温恒容下,容器①、②中达到平衡为等效平衡,平衡时相同组分的浓度相等,故C错误;
D.若容器①体积为0.20L,增大压强平衡向正反应方向移动,放出热量多,反应物转化率增大,即达平衡时放出的热量大于46.3kJ,故D正确.
故选:C.
点评 本题考查化学平衡计算与影响因素、等效平衡等,题目难度中等,注意对等效平衡规律的理解掌握.

练习册系列答案
相关题目
13.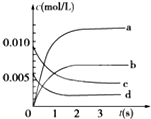 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;升高温度,NO的浓度增大,则该反应是放热(填“放热”或“吸热”)反应.
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
7.潮湿的氯气、新制的氯水、酸化的NaClO溶液均能使有色布条褪色,原因是它们之中均含有( )
| A. | Cl2 | B. | HClO | C. | ClO- | D. | HCl |
8.下列反应不属于氧化还原反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |