18.在一固定容积的密闭容器中加入2molX和3molY气体,发生如下反应:nX(g)+3Y(g)?2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为 ( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
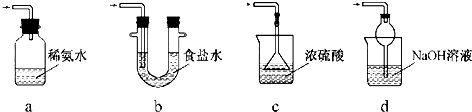
17.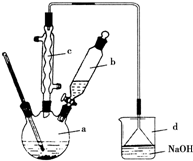 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
(1)实验装置中,仪器c的名称为球形冷凝管,作用为冷凝、回流.
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3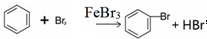 .
.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.
 实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:| 苯 | 溴 | 溴苯 | |
| 密度/g.cm3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.写出a中发生反应的化学方程式:2Fe+3Br2═2FeBr3
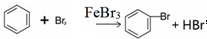 .
.(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入无水氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,需进行的操作方法为蒸馏.
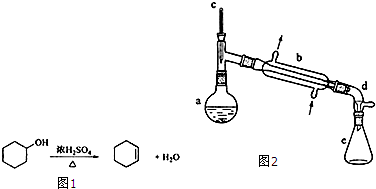
15.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如图1和实验装置如图2:可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加B.重新配料C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶B.温度计C.分液漏斗D.冷凝管E.接收器
| 相对分 子质量 | 密度 (g•cm-3) | 沸点 ℃ | 溶解性 | |
| 环己 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加B.重新配料C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.蒸馏烧瓶B.温度计C.分液漏斗D.冷凝管E.接收器

11. 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:
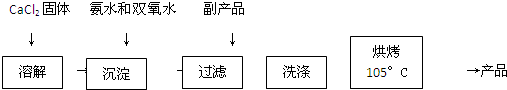
反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
(6)测得CaO2样品的纯度偏低,其原因可能是AB
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.
0 172778 172786 172792 172796 172802 172804 172808 172814 172816 172822 172828 172832 172834 172838 172844 172846 172852 172856 172858 172862 172864 172868 172870 172872 172873 172874 172876 172877 172878 172880 172882 172886 172888 172892 172894 172898 172904 172906 172912 172916 172918 172922 172928 172934 172936 172942 172946 172948 172954 172958 172964 172972 203614
 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:

反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
| 实验序号 | ① | ② | ③ | ④ |
| 消耗 KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.