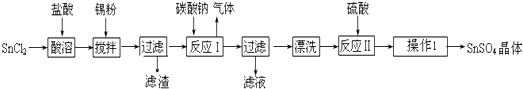
5. 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)环形玻璃搅拌棒的作用是使溶液上下混合均匀,保证溶液上下的温度达到一致.
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g•℃),则该反应的中和热为△H=-56.01kJ/mol.?
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热数值偏小,但中和热为负值,所以中和热偏大.?
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)环形玻璃搅拌棒的作用是使溶液上下混合均匀,保证溶液上下的温度达到一致.
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热数值偏小,但中和热为负值,所以中和热偏大.?
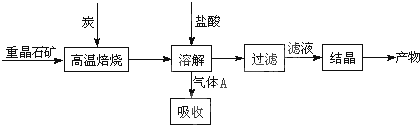
4.晶体硅是一种重要的非金属材料,工业上用碳在高温下还原石英砂(主要成份为含铁、铝等杂质的二氧化硅)得粗硅,粗硅与氛气在450-500℃条件下反应生成四氯化硅,四氯化硅经提纯后与过量H2在1100-1200℃条件下反应制得高纯硅.以下是实验室制备SiCl4的装置示意图.
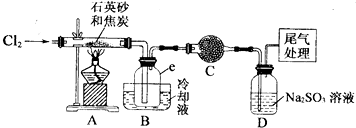
实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
请回答下列问题:
(I)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑
置A.B间导管短且粗的原因是防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管
验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2S03的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2S03已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.

实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
(I)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑
置A.B间导管短且粗的原因是防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管
验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2S03的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2S03已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.
3.下列各组溶液,不需要其他试剂就可以鉴别出来的是( )
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
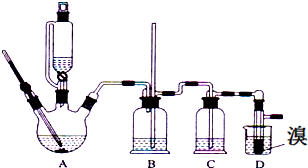
2.实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
有关数据列表如下:
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.
16.为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
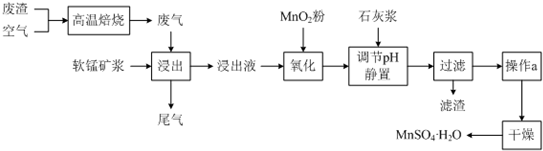
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7~8.3.
0 172640 172648 172654 172658 172664 172666 172670 172676 172678 172684 172690 172694 172696 172700 172706 172708 172714 172718 172720 172724 172726 172730 172732 172734 172735 172736 172738 172739 172740 172742 172744 172748 172750 172754 172756 172760 172766 172768 172774 172778 172780 172784 172790 172796 172798 172804 172808 172810 172816 172820 172826 172834 203614

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7~8.3.