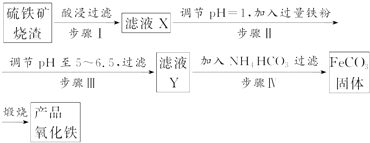
题目内容
19.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如图1.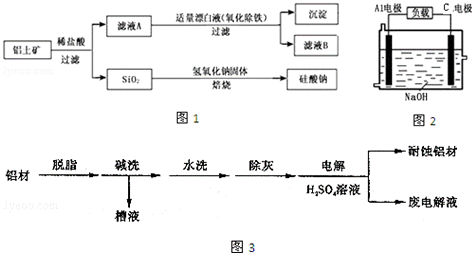
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①检验滤液B中是否还含有铁元素的方法为取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素(注明试剂、现象).
②由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、过滤、洗涤.
(2)新型铝空气电池具有比能量大、质量轻、无毒和危险性等优点.Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的原因之一,电极被腐蚀的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命.图3为铝材表面处理的一种方法
①碱洗的目的是除去铝材表面的自然氧化膜,原理是_Al2O3+2OH-═2[AlO2]-+H2O(用离子方程式表示).为将碱洗槽液中铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的b.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,则阳极电极反应为2Al+3H2O-6e-═Al2O3+6H+.取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是3HCO3-+Al3+=3CO2↑+Al(OH)3↓.(用离子方程式表示)
分析 铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入盐酸,过滤得SiO2沉淀,滤液A为到氯化铝、氯化铁、氯化亚铁混合溶液,加入适量的漂白粉氧化除铁得沉淀为氢氧化铁,滤液B为氯化铝溶液,
(1)①滤液B中如果有铁元素,主要是氯化铁,铁离子可以用KSCN溶液检验;
②滤液B加入浓盐酸抑制氯化铝的水解,蒸发浓缩,冷却结晶,过滤洗涤,可得氯化铝晶体;
(2)铝为活泼金属,既能与酸反应,又能与碱反应;
(3)①铝材表面的自然氧化膜是氧化铝,碱洗应用了氧化铝的两性,故反应离子方程式为Al2O3+2OH-═2[AlO2]-+H2O;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀.
解答 解:(1)①滤液B中如果有铁元素,主要是氯化铁,铁离子可以用KSCN溶液检验,具体方法是取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
②加入浓盐酸抑制氯化铝的水解,蒸发浓缩,冷却结晶,过滤,洗涤,
故答案为:冷却结晶;过滤;
(2)Al电极易被NaOH溶液腐蚀,即铝与氢氧化钠反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)①铝材表面的自然氧化膜是氧化铝,Al2O3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗除氧化膜,故反应离子方程式为Al2O3+2OH-═2[AlO2]-+H2O;碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:Al2O3+2OH-═2[AlO2]-+H2O;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;3HCO3-+Al3+=3CO2↑+Al(OH)3↓.
点评 本题考查了铁、铝性质的综合应用和氧化铝提纯制备流程分析应用以及新型电池,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原溶液中投入铁粉物质的量是0.25mo1 | |
| B. | 原溶液中HNO3的浓度是2.0mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=3:1 |
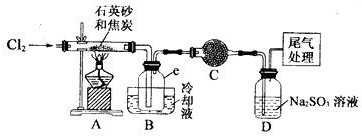
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑.装置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸;硅被氧化得不到高纯硅.
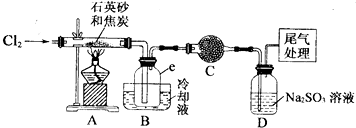
实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
(I)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑
置A.B间导管短且粗的原因是防止生成物的AlCl3、FeCl3等杂质凝结成固体堵塞导管
验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2S03的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2S03已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体(1分),再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 二氧化硫具有氧化性,可用于漂白纸浆 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净水剂 |
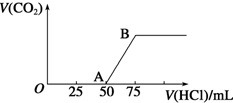 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |