题目内容
5.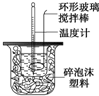 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)环形玻璃搅拌棒的作用是使溶液上下混合均匀,保证溶液上下的温度达到一致.
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热数值偏小,但中和热为负值,所以中和热偏大.?
分析 (1)根据中和热的测定原理分析解答;
(2)根据少量盐酸在反应中挥发,反应的盐酸偏少,放出的热量偏小;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)根据醋酸为弱电解质,电离过程中需要吸收热量进行判断;
解答 解:(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒充分混合反应酸碱,加快反应速率,使上下温度一致;
故答案为:充分混合反应酸碱,加快反应速率,使上下温度一致;
(2)少量盐酸在反应中挥发,盐酸挥发吸收热量,且盐酸偏少,放出的热量偏小,测得的中和热数值偏低;
故答案为:偏小;
(3)3次温度差分别为:6.6℃,5.5℃,6.8℃,第2组误差较大,舍去,温度差平均值为6.7℃,50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液进行中和反应生成水的物质的量为0.05L×1.0mol/L=0.05mol,溶液的质量为100ml×1.00g/cm3=100g,温度变化的值为△T=6.7℃,则生成0.05mol水放出的热量为Q=m•c•△T=100g×4.18×10-3 kJ/(g•℃)×6.7℃=2.8006kJ,所以实验测得的中和热△H=-$\frac{2.8006kJ}{0.05mol}$=-56.01kJ/mol;
故答案为:-56.01kJ/mol;
(4)由于醋酸为弱酸,醋酸电离要吸收能量,造成测得的中和热偏小,
故答案为:偏小;用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热数值偏小,但中和热为负值,所以中和热偏大.
点评 本题考查了中和热的测定,题目难度中等,注意掌握中和热的测定方法,明确中和热测定中必须尽量减少热量的散失,无论使测定数据更准确,还需要保证酸碱中有一种物质过量.

 阅读快车系列答案
阅读快车系列答案| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=4,x=27mL.
(3)反应③的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)=1:20;
(5)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是ABC(填正确答案的标号).
A.c(Na+)>c(HRO${\;}_{3}^{-}$)>c(H+)>c(RO${\;}_{3}^{2-}$)>c(OH-)
B.c(Na+)+c(H+)=c(HRO${\;}_{3}^{-}$)+2c(RO${\;}_{3}^{2-}$)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO${\;}_{3}^{2-}$)+c(OH-)
D.两溶液中c(Na+)、c(HRO${\;}_{3}^{-}$)、c(RO${\;}_{3}^{2-}$)分别相等.
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于10.5 |
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| B. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀可能会同时发生 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 | |
| D. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因:反应中生成的锰离子具有催化作用,所以随后褪色会加快.当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色由无色变成紫红色,且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.