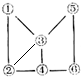
2.下列物质中既能与盐酸反应又能与NaOH溶液反应,且都不产生气体的是( )
| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
1.用 NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
20.已知A和B生成C的反应方程式:2 A(g)+B(g)=x C(g).甲容器充入2mol A和1mol B,达平衡后,C在平衡混合气中的体积分数为φ、物质的量n1;乙容器中充入1.4mol A,0.7mol B和0.6mol C,达平衡后C在平衡混合气中的体积数为φ、物质的量为n2,下列说法正确的是( )
| A. | 若甲乙两容器均为恒容容器,则x必等于2 | |
| B. | 若甲乙两容器均为恒压容器,则x必等于3 | |
| C. | 若甲为恒压容器,乙为恒容容器,且x不等于3,则n1必大于n2 | |
| D. | 若甲为恒容容器,乙为恒压容器,且x等于3,则n1必大于n2 |
18.科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的.下列判断错误的是( )
| A. | 处理过程中,PH减小 | B. | 废水处理中,亚硝酸盐被还原 | ||
| C. | 废水处理时铝单质转化为AlO2- | D. | 铝粉颗粒大小影响废水处理的速率 |
15.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般可采用下列反应合成甲醇:
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
由表中数据判断△H<0 (填“>”、“=”或“<”).
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
CO(g)+2H2(g)═CH3OH(g)△H
(1)化学平衡常数(K)的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
(3)某温度下,将6mol CO和4.4mol H2充入2L的密闭容器中,10min该反应达到平衡,测得c(CO)=2.4mol•L-1,则用H2表示的10min内该反应的反应速率为0.12mol•L-1•min-1,此时的温度为300℃(从上表中选择),H2转化率=54.5%.
(4)判断该可逆反应达到化学平衡状态的标志是③④⑥(填序号).
①单位时间内,消耗2mol H2,同时生成1molCH3OH
②混合气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④CO、H2、CH3OH的浓度均不再变化
⑤CO、H2、CH3OH的分子数目比为1:2:1
⑥混合气体的总压强不再变化.
13.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论正确的是( )
0 172475 172483 172489 172493 172499 172501 172505 172511 172513 172519 172525 172529 172531 172535 172541 172543 172549 172553 172555 172559 172561 172565 172567 172569 172570 172571 172573 172574 172575 172577 172579 172583 172585 172589 172591 172595 172601 172603 172609 172613 172615 172619 172625 172631 172633 172639 172643 172645 172651 172655 172661 172669 203614
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
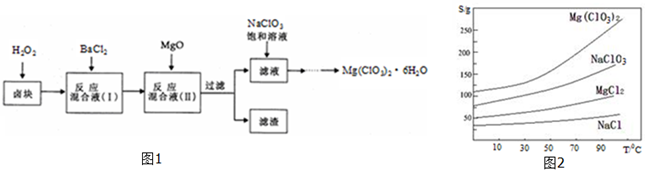
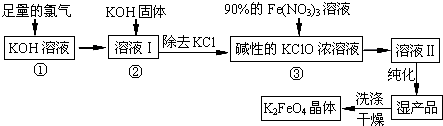
 ,试写出:
,试写出: .
. .
. .
. ,
,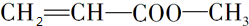 ,
,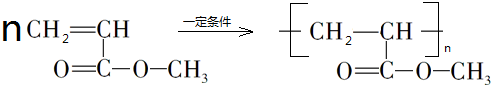 .
.